漫谈SPP填料发展史--图解HPLC填料中的表面多孔颗粒
漫谈SPP填料发展史--图解HPLC填料中的表面多孔颗粒
表面多孔颗粒(superficially porous particle,以下简称SPP)至今已有40多年的发展历史。最近,这种拥有坚固粒核和表面薄层多孔结构的填料又获得了长足发展——粒径低于3μm的表面多孔颗粒较粒径低于2μm的全多孔颗粒,具有更好的柱效,且压降只有后者的一半。本文介绍了早期和现代SPP填料的特点,以及SPP相关产品用于大、小分子分离中的优势。
在传统的液相色谱与高效液相色谱(HPLC)中,全多孔填料诸如硅胶、氧化铝、离子交换树脂等被广泛应用。这些填料之所以行之有效,关键在于它们有较高的表面积、样品容量、不错的保留时间,还能键合不同的有机官能团。
在20世纪60年代早期,我们现在所熟知的HPLC还没有出现,研究人员仅从理论上预言液相色谱将变得更加高效。大部分的色谱工作者使用粒径超过100μm的多孔颗粒做填料,开口玻璃柱做 。这些填料主要由不同孔径的筛网过滤不规则颗粒分类得来。色谱工作者利用液体自身的重力来使流动相通过玻璃柱,在柱子出口收集目标物,再把收集到的流出物进行离线分析,如紫外可见光光谱分析。以今天的标准来看,这些色谱图的峰型并不出色,而且由于被测物在多孔填料中的吸附和解吸太慢,即使通过加压提高流动相的速度,也只能得到更宽的峰型。要提高色谱分离的速度,就要考虑降低填料上微孔的深度、缩短迁移路径,或提高迁移速率。
早期的SPPs介绍
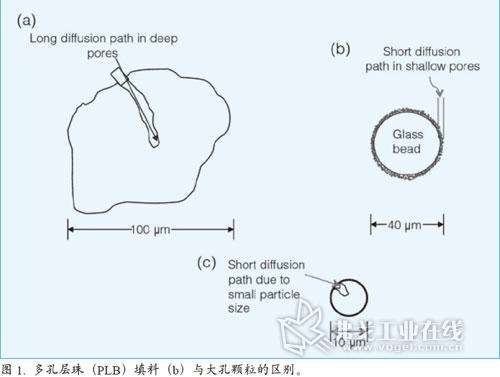
德国法兰克福大学的Horvath教授预言使用坚硬物质做核心,粒核外面再覆盖一层薄薄的多孔固体作为固定相能提高物质的迁移速率。Horvath教授与其同事最先发布多孔层珠(PLB)填料,并用于核苷酸的离子交换色谱分离。这种SPP填料以玻璃为核心,外面覆盖着薄薄的聚苯乙烯-二乙烯苯聚合树脂,树脂上再键合阴离子交换官能团。
图1展示了其与之前的大孔颗粒的区别。图1a是早期使用的典型大多孔颗粒。物质进入柱子后会扩散到这些颗粒的孔中,由于进出粘滞流动相时的扩散速度慢,因此需相当长的时间才能洗出。缓慢的物质迁移速率是色谱图中峰型变宽的原因。提高 的使用温度可以降低流动相的粘度,但只能带来少许改善且在当时也不易操作。图1b展示了SPP的原理。直径为40μm的球形玻璃珠被用作基体,球体的外面覆盖薄薄的离子交换树脂或硅胶(约1~2μm)。当物质扩散到SPP颗粒填料中时,其扩散路径被限制在较窄的范围内。通过缩短填料中的孔隙深度,SPP填料缩短了物质在粘滞流动相中的扩散路径。使扩散只能在填料的表面薄层上进行,因此物质在两相间的迁移速率就会大大提高。由此可以看出,表面薄层越薄,物质迁移速率越高,柱效就会越好。当然,表面薄层变薄,容量因子与样品容量就会变低,因此需要在薄层厚度与容量之间取得平衡点。
相比早期LC所用的大孔颗粒,SPPs填料能使分离速度更快(只需20~30min,而前者往往需要几小时),分离效果更好(理论塔板高度为1~2mm),且检测灵敏度更高。用户通过简单的机械振动,就能把SPPs填料干法装填到50cm与1m的不锈钢柱子内。许多化学基团被尝试键合到薄层上,用于不同的色谱分离,比如正相、反相、离子交换色谱。在70年代早期,许多色谱分离方法的成功开发正是得益于SPP柱子的应用。
20世纪60年代末到70年代初, SPPs填料的商业化,以及在线紫外检测器的出现大大促进了HPLC的发展。稍后出现的微型全多孔硅胶颗粒在大小、装填上取得的突破性进展,柱效由此得到大幅提高,逐步取代早期的SPPs填料。图1c展示的微型全多孔填料改善了物质的迁移,使柱效提高了至少一个数量级。此外,更小的多孔颗粒也意味着更大的表面积,能容纳更多的样品量。这些填料也能用于制备色谱以及为取得更好的检出限而采用的大进样模式。
现代的SPPs
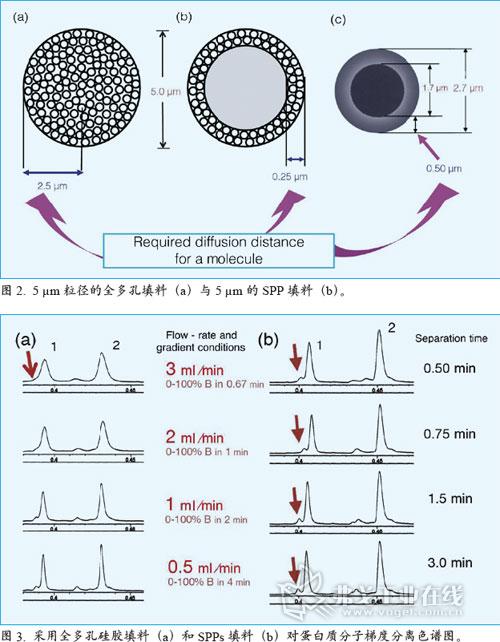
与早期直径40μm的填料相比,现代SPP填料体积明显减小——直径5.0μm,薄层厚度0.25μm,孔径300Å。颗粒的核心变成坚固的SiO2,表面覆盖一层薄薄的纳米颗粒。这种SPP 被广泛用于生物大分子(如蛋白质)的快速分离。生物大分子的扩散系数只有普通小分子的1/10,SPP填料上的薄层能使得这些扩散缓慢的蛋白子分子只在较窄的范围内渗透(坚硬的核心阻止了其继续往前扩散)。对比同样大小的全多孔颗粒,SPP具有较快的迁移速率,同时能在不损失太多柱效的前提下保证较高的流速。图2a和2b展示了5μm粒径的全多孔填料与5μm的SPP填料。对于前者,假设物质分子扩散到颗粒的中心位置再返回,整个迁移路径约为5μm(进出分别为2.5μm)。由于生物大分子的迁移十分缓慢,会导致峰型变宽,这种情况在需要提高流速的快速分离上就更加明显。
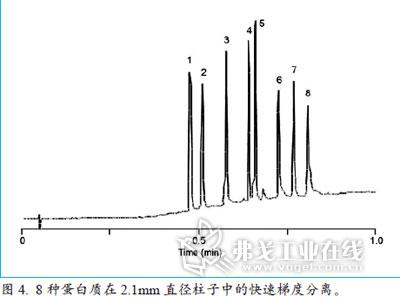
图2b是同样粒径的SPP填料,由于蛋白质分子只需在颗粒外面的薄层进行扩散,其整个迁移路径只有0.5μm(进出分别为0.25μm)。这一距离只有前面全多孔颗粒的1/10,所以扩散的时间大幅缩短,峰型更尖锐。即使是在高流速下,峰宽仍比全多孔颗粒的填料窄。
从图3a、b的色谱图比较可以看出两者的区别(柱温:70℃,波长:210nm;峰1:lysozyme;峰2: myoglobin;)。分别对一组蛋白质(lysozyme与myoglobin)在75×2.1mm 中进行高流速色谱分离。图3a采用大孔径(300Å)的全多孔硅胶填料,图3b采用大孔径(300Å)的SPPs填料。对蛋白质一般采用梯度分离,因为等度分离中采用不同填料造成的柱效差异会更大。在梯度分离时,由于SPP填料的柱子具有更快的迁移速率,所以峰型比全多孔填料明显尖锐。在SPP填料的柱子分离中,很容易观察到蛋白质lysozyme,即峰1前面有一个不完全分离的杂质峰。将两种不同填料柱子对应的谱图在不同流速下做平行比较。同时,当流速提高,两者的保留时间皆有缩短,梯度时间需做相应调整。
为了更好描述SPP填料的分离效率,图4展示了8种蛋白质在2.1mm直径柱子中的快速梯度分离,该过程仅耗时0.75min。
粒径低于3μm的SPP
上文提及孔径为300Å的SPP填料适用于大分子的快速分离,而近来亚2μm(1.5~1.9μm)填料的发展也使小分子的快速分离得以实现。装填了亚2μm填料的50mm短柱,其分离时间已少于1min。由于采用粒径小的填料会造成柱压增大,有时须用超高压液相色谱UHPLC。
最近,SPPs再次得到人们的重视。各种新型的SPPs雨后春笋般出现。这些填料颗粒直径为2.6~2.7μm,外层的多孔层厚度为0.5μm,孔径90~120Å,适用于小分子的分离。相对亚2μm的SPPs填料,此类填料能提供较低的柱子压降(比前者降低40%~60%),而仍具有较短的扩散路径等优点。通过特殊的合成工艺,能将SPP微粒粒径控制在很窄范围(远小于全多孔填料微粒)。这样填料能更有效率地装填到 中,也能降低范第姆特方程方程(H=A+ B—u +Cu)式中的参数A(涡流扩散项)。通过同时降低范第姆特方程方程式中的3个参数,这些用粒径为2.6~2.7μm的SPP装填的柱子,柱效能媲美亚2μm的SPP柱,能在较低的压 降下实现高柱效,用户可继续使用原来的LC系统,而不必升级到UHPLC了。
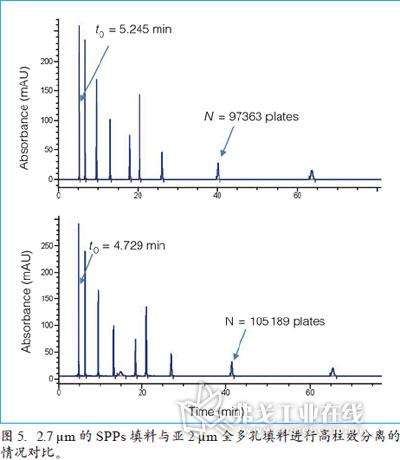
此外,利用UHPLC系统也使得我们能通过使用更长的SPP柱子,获得更大的理论塔板数。图5对比了使用SPPs填料与亚2μm全多孔填料进行高柱效分离的情况。对比试验是用装填上述两种不同填料的长柱进行的,两根柱子都有超过10万的理论踏板数,尺寸皆为55cm×2.1mm,具有基本相同的塔板数和分离时间。经对比发现,两者最大的不同是柱压的差别。亚2μm的全多孔填料的柱压已超过1000bar(15000psi),而粒径2.7μm的SPP填料柱压只有547bar(8200psi)。
商业化的现代SPP柱
目前,只有几家公司能提供适用于大分子和小分子分析的SPP柱子。菲罗门公司除了提供2.6μm粒径的SPP填料,还推出了1.7μm粒径规格的填料,该填料在相同的压降下,能得到比亚2μm全多孔填料更好的分离效率,这对UHPLC系统来说是很大的挑战。由于SPPs能用于HPLC与UHPLC系统,所以在未来会有更多公司推出此类产品。另外,越来越多针对亚3μm的SPPs填料的固定相也在研发当中,在不久的将来,其固定相的种类能与亚2μm或常规的HPLC全多孔填料相当。
小结
SPP的概念问世已久,而今俨然已成为亚2μm全多孔填料的强劲对手。最新的SPP产品能为大分子和小分子提供快速分离,特别是进行小分子分离时,其压降比亚2μm的全多孔填料产品要低许多。与亚2μm全多孔填料相比,SPPs具有较厚的微粒薄层,且SPPs填料的可用表面积只下降了25%,由于SPPs颗粒的填充密度高,相同规格的柱子里,SPP拥有的固定相基团数量基本与前者相当的。因此,两种柱子的样品容量差距不大。无论是用于小分子分析的2.6~2.7μm粒径的SPP柱子,还是用于大分子分析的5μm粒径的SPP柱子,其进出口都采用2.0μm孔径的筛网密封,因此不易发生堵塞。随着用户对这项技术的日益熟悉,SPP填料将有一个美好的前景。
《LCGC Asia Pacific》
展源
何发
热点文章
-
【干货】革兰氏染色的原理、步骤、误区及结果判读!
2025-09-28
-
【干货】如何进行氢氧化钠溶液的标定!
2025-10-14
-
【细看】常见26种试剂的危害与防护!
2025-09-29
-
【必看】 安全分类分级你都了解了吗?
2025-11-17
-
【谨记】 安全“四不”要牢记!
2025-11-10
-
危险源如何辨识?!
2025-09-22
-
紫外杀菌灯的原理、使用及维护
2025-10-31
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来 媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多