质谱分析法是一种分析技术方法,可用于研究具有高度特异性的复杂生物化学样品的组成成分。这种技术已经成为了生命科学领域的黄金标准,如蛋白质组学,代谢组学,毒理学。这得益于其特异性和可以量化极少量的荷尔蒙,疾病,生物标志物,代谢物的能力。
尽管质谱分析法已经被广泛接受,但仍有相当多的挑战阻碍其被临床和研究室采用。
最明显的障碍包括对大型异构样品进行常规分析时分析生产量低,空间分辨率低,如离体组织,在样本解剖结构的背景下从微米到毫米范围内进行测量具有重大意义。
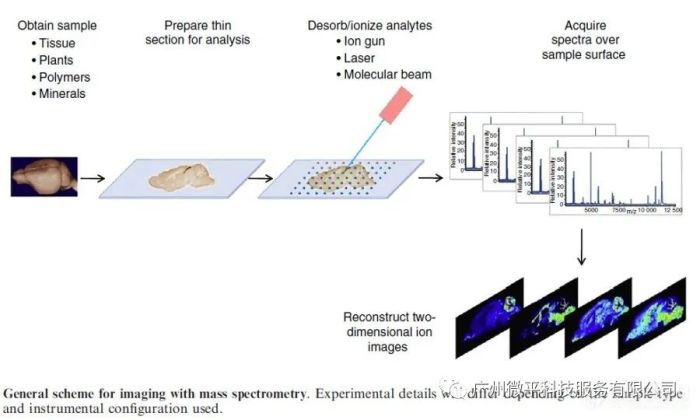
成像质谱(IMS)是一种非常灵敏的分子成像技术,可提供组合的分子信息和空间分辨率。它允许从组织切片、单细胞或其他物质表面直接鉴定和定位化合物分子。成像质谱研究的核心特点是质谱仪的高灵敏度、技术的无标签性、对肽和蛋白质的成像能力,以及从个体水平(几百微米)到细胞水平(几十纳米)空间分辨率。成像质谱允许在单个实验中同时检测数千个不同分子的图像。
因此,它是一种有效的多组分分子成像技术。科学家们已经开发了许多不同的成像质谱方案和仪器来研究生物内源性化合物,如脂质、肽和蛋白质,以及外源化合物,如聚合物,或者用于研究组织处理药物的分布。这些研究提供了从亚细胞层次到有机体层次生物过程的详细情况。
当今,成像质谱主要是用于病理学离体组织研究的技术,并不具备MRI(磁共振成像)或PET(正电子发射断层摄影)扫描的体内诊断能力。然而,它可以作为体内成像的补充技术来验证生物分子的分布代谢规律或不同疾病阶段药物的递送方式。许多研究人员正在探究用这种补充成像方式来解决分子分布的具体问题。这种做法的理由很明显。
没有其他单一的成像技术能够以适当的空间分辨率、时间分辨率及生物学状态提供分子结构和解剖信息的适当组合。
与其他分子成像方法相比,如MRI,PET或免疫组织化学(IHC),成像质谱有一个独特的特征:它可以使化合物分子可视化而又无需标记,这可以实现其他技术所不能实现的对新化合物分布规律的研究。通常,它是在使用影响色差的常规染色剂(例如通常用于组织染色的苏木精和曙红(H&E)情况下,可以做化合物分子鉴定的唯一工具。
它可以用于常规组织学染色剂不可实现的化合物分子分布规律的研究。
这是因为在病理学中使用的常规染色剂只提供一般组织分型,而不识别特定分子,不提供分子修饰及其组合信息等。不能被常见组织染色剂染色的几种药物和代谢物如表1所列。
IMS需要从被研究物质的表面解离和离子化化合物分子。主要有两种物理方法:(1)用载能带电粒子碰撞分析物表面,(2)用来自脉冲相干光源的光子照射表面。
带电粒子主要用于二次离子质谱(SIMS)成像。在这种方法中,分析物表面暴露于高能聚焦的一次离子束下。
离子撞击会导致表面上下分子的级联碰撞,从而引起表面分子的移动和电离。
随后,碰撞产生的二次离子可以进入质量分析器分析以确定其性质。碰撞能量通常会保持较低,以确保一次离子可以与不同区域表面分子相作用,并且确保已碰撞区域不再进行二次碰撞分析。低于表面层分析碰撞能量的实验被称为静态SIMS实验。高于该碰撞能量的实验,被称为动态SIMS实验。在动态SIMS实验过程中,分析物表面会发生持续的变化。在静态SIMS实验中,被分析的表面通常在1%以内。
在SIMS实验过程中,大量的内部能量被转移到表面分子中。这会导致表层化合物分子产生大量的碎裂。
这使得该方法不适合直接研究大分子物质,如肽和蛋白质等。该方法可以较好地观测待测物表面元素和小分子化合物分布规律。化合物碎裂模式与电子碰撞电离中观察到的碎裂模式相似。
最常用的一次离子种类是铟和镓。它们主要应用于半导体表面上的元素和有机杂质研究,以及薄层表面涂层的研究。受益于较大簇离子或分子离子的应用,切片组织等生物表面也可以被分析。较大的一次离子有Aun+、Binm+、C60+等。这些离子可以使完整次级分子离子的产率更高,并且减少了分子离子碎裂。此外,这些离子的应用还可以显著降低对表面下层分子的破坏,从而增加三维成像实验成功的可能性。
所有的SIMS实验与以上所述的离子光束均需要保持真空环境,否则初级离子会因为平均自由程太短而不能到达分析物表面。解吸电喷雾电离(DESI)是大气压下的解吸和电离技术。它会产生电喷雾液滴,然后在大气条件下被传送到待分析物表面。
溶剂液滴吸附到表面分子上,从而产生与常规电喷雾质谱电离相似的二次离子。
这种方式可以产生带多电荷的准分子离子。据报道,该方法适用于多种待测物的表面分析,包括药物片剂、血迹和组织切片等。研究显示,DESI技术用于组织成像可以可视化观察脑和肿瘤组织切片中的磷脂和脂质。
能够从表面解离和电离分子的第二种方法是光子与表面分子产生相互作用。通常,脉冲激光束聚焦在分析物表面上。由表面层吸收的光子能量会导致表面材料的爆炸性去除或消融。
当使用红外(IR)或可见光时,光子能量主要转化为表面振转能量。在紫外线或真空紫外线(VUV)光下,光子能量增加可以引发大量的电子激发。
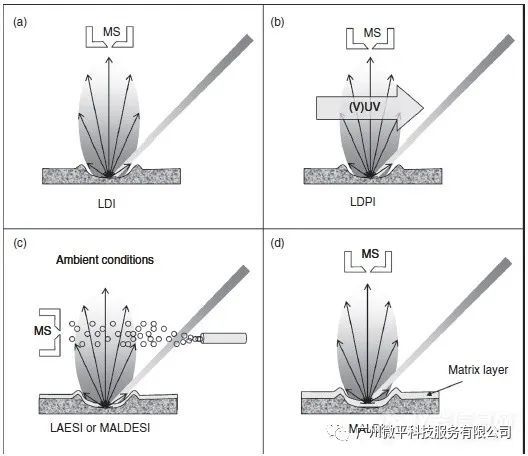
如果积累在待分析化合物分子中的内部能量足以引起直接电离,该过程被称为激光解吸和电离(LDI),如图1(a)所示。在激光解吸过程中积累的内部能量通常比较高,表面分子可以发生大量的碎裂。此外,有机化合物的低电离效率使得该技术不太适合于大分子质谱分析。
这些情况下,可以应用激光解吸后电离(LDPI)策略来电离解吸过程中产生的中性粒子(图1(b))。后电离策略可以在真空条件下通过UV或VUV波长范围内的二次能量激光束照射实现。
最近研究表明,激光解吸可以有效地与ESI离子源联用,从而在大气压力条件下可以进行激光烧蚀电喷雾电离(LAESI)(图1(c))。这种组合增加了可以用激光解吸策略分析的化合物类别,并能减少化合物碎裂。当与电感耦合等离子体质谱(ICP-MS)组合时,激光烧蚀可以成功地用于待测品表面元素的定量分析。烧蚀的组分被等离子体源雾化并离子化成构成元素和同位素离子,随后通过质谱仪进行分析。当与光发射光谱法结合时,使用从ICP发射的光可以获得更多定量基本信息。
由于存在大量碎裂,直接LDI策略不适用于分子量超过500Da的生物大分子分析。这时可以选择使用能量调节基质。分析物混合或被涂布在待分析物表面上(参见图1(d))可以克服这个限制。在20世纪80年代晚期,由Karas和Hillenkamp构想的这种技术被称为基质辅助激光解吸和电离(MALDI)。
它是现代蛋白质组学研究中的关键技术,可以应用于生物大分子,如蛋白质和DNA分子的解吸和电离。
在复杂待测物表面的MALDI分析中,基质辅助方案有更多的用途。
首先,应用基质后,它可以将复合物样品中的待测分子重构在基质晶体中间或者表面。这些分析物掺杂基质晶体的形成,可以将待分析物与其他辅助因子如盐等分离,并可以将大分子分散在基质中。
用脉冲激光对晶体表面的后续照射能够快速地使样品过热。这是作为激光能量强吸收体的基体受到电子激发(UV-MALDI)或振动激发(IR-MALDI)作用的直接结果。
协同运动的过热基质与其夹带的分析物可以被引导到的真空中。这有助于分析物分子气相化的非破坏性转变。基质的最后一个目的是通过电荷转移促进分析物分子的电离。
该方法通常会使[M+X]+型的阳离子转化成完整的准分子离子,其中X表示产生的阳离子的类型。最常见的阳离子是氢、钠和钾。
为保证分析成功,分析物分子必须与固体基质材料共结晶,并且这些基质应该是过量的。
最常用的基质与分子的比例在103:1至105:1的范围内。根据经验,研究的分析物的质量越高,完全解吸所需的基质剩余越多。
近来敞开式解吸策略的发展已经产生了一些进步,该策略也需要使用基质。
类似于LAESI方法,其基质、分析物混合物需要在基材上共结晶,这样可以有更多完整样品从表面移除
。MALDI离子会受质谱入口和样品表面之间电场的作用而发生偏转。从MALDI基质上产生的中性粒子含有大量在真空MALDI实验中丢失的分析物分子。它们可以被吸附在尚未完全雾化的电喷雾液滴表面。接下来是常规的产生多电荷离子的电喷雾电离过程。
该过程又缩写MALDESI(基质辅助激光解吸电喷雾电离),它可以将MALDI在敞开环境中的优点以及电喷雾电离的灵敏性结合起来。
MALDI技术和液相色谱(LC)分离技术的成功联用,提高了复杂混合物的分离检测效率。分析复杂混合物时,MALDI会受到显著的离子抑制。不同物化性质的化合物分子共存通常会导致一种或几种组分优先于其他组分离子化。离子抑制效应是许多分析学科量化研究的主要障碍。对MALDI质谱强度差异的解释本质上是定性的。
克服该问题的一个方法是进行色谱分离以降低混合物的复杂性。
许多nano-LC-MALDI方法已经实现了将分离时间尺度转换为空间分布尺度。自动点样技术可以将一系列二维纳升液相洗脱液滴(通常每滴为150纳升)沉积到MALDI基质预涂层上。也可以采用其他方法将基质溶液与LC洗脱液混合,并将该混合物液滴有序沉积在干净的基质靶板上用于质谱分析。
使用能量调节基质材料的优点并非仅限于光子解吸和电离技术。MALDI质谱技术的成功使MALDI基质在SIMS(二次粒子质谱分析法)样品制备中的应用成为可能。分析物与MALDI基质(2,5-二羟基苯甲酸/DHB)的共结晶,更加方便了采用基质增强型SIMS(ME-SIMS)方法对质量超过10kDa的大分子离子进行检测。因此,这种仅基于SIMS电离方法产生完整大分子离子(肽,蛋白质,寡核苷酸)的技术是成功的。
有人提出,基质在ME-SIMS中的作用与在MALDI中的作用相似:都是为分析物分子提供了一个嵌套环境,并提供了质子来增强电离。以DHB为基质可以获得最佳结果,可能解释是DHB提高了样品表面区域中分析物的浓度。由于ME-SIMS(与MALDI相比)仅检测表面50nm之内,所以分析物的定位在样品制备中至关重要。分析物分子必须存在于晶体的表面,因为在静态SIMS条件下不能检测到基质共结晶的较深层次。
IMS的一个关键参数是可实现的空间分辨率。空间分辨率决定细胞和组织表面可观察到的细节。获得质量分辨率图像的最常见方法是使用微探针或扫描模式。微探针模式质谱成像通过SIMS扫描样品上的电离探针束或移动样品通过MALDI对焦进行。对于每个特定位置,带电离子束与样品相互作用,存储坐标,并获得位置相关离子产生的质谱数据。以这种方式构建光栅,光栅中的每个点都具有与其相关联的质谱数据。
使用专用软件,可以从这些数据集中构建质量分辨的离子图像。微探针成像实验中最大的可实现空间分辨率由微探针的尺寸决定。
在技术上,光栅中每个点的精度是控制分辨率的另一个因素,但是对于SIMS和MALDI成像,通常这不是一个问题。
此外,实验实现的空间分辨率受样品制备(基质)和灵敏度(信噪比)相关因素的影响。
1、二次离子质谱(SIMS)和解吸电喷雾电离质谱(DESI)成像质谱的空间分辨率
SIMS使用离子源的大多是由液体金属离子枪构成。Ga +和In +主要用于表面元素和小分子分析。使用这些枪可以获得的空间分辨率由发射器的大小,离子柱中的静电光学元件和主光束电流决定。后者通常保持较低以防止光束的空间电荷膨胀和分辨率损失。
当在低电流下进行调谐时,这两支枪可以提供50nm的焦点。金属簇光束Aun+、Bin+以及C60+可以在非常低的光束电流下提供100-200nm的光斑尺寸。低光束电流通常需要更长的实验时间。因此,为了应用更大的束电流增加分析速度,空间分辨率通常会受到一定损失并减小到大约1μm。DESI使用指向表面的带电溶剂液滴喷射流。喷射流与表面的润湿相互作用中,作用区域大小决定了空间分辨率。
研究表明,DESI成像的常规空间分辨率为1mm左右。
2、激光直接成像(LDI)和基质辅助激光解析电离(MALDI)成像质谱的空间分辨率
聚焦激光束的分辨率是波长决定的,并受阿贝衍射极限的限制。长波长的红外激光器难以聚焦在50μm以下。商业仪器中的UV激光光斑的物理尺寸限制在约10μm。在商业仪器上,大多数实验用激光光斑尺寸在50和250μm之间。这个选择是由灵敏度和完成实验所需的时间决定的。特殊的共焦目标可以将斑点尺寸减小到1μm,但是使用MALDI的这些小斑点所需的激光阈值通量对于组织中化合物的无损分析是不是太高仍存在实质性的争论。
初步实验显示了其从分析物获取高分辨率图像的能力。替代方法是使用常规MALDI-ToF仪器的过采样方法增加空间分辨率。
在这种方法中,激光探针点的移动增量小于光点直径。所有样品在第一个采样点完成后,每个采样增量都会从比激光焦点尺寸小得多的区域采集信息,从而达到增加空间分辨率的目的。这种方法的两个缺点是有限的质谱串联可能性和较大的总样品消耗量。
使用上一节描述的解吸和电离技术,可以在复杂表面产生原子和分子离子。质谱图像的产生需要对这些产生的离子进行后续质量分析。现代质谱方法提供了一系列质量
来达到此目的。本文介绍三种类型的质量
,为生物表面的MALDI或SIMS质谱成像提供独特的分析能力。
IMS中最常用的质量分析器是飞行时间分析仪。它需要产生脉冲离子,这一要求理想地与MALDI和SIMS要求兼容。所有离子都具有相同的加速电位。相同质荷比的离子将在其解吸过程产生的初始动能之上获得相同的动能。
因此,
它们的速度取决于它们的质荷比,并且离子可以通过在无场区域中的漂移而分离。离子检测是通过多通道板(MCP)类的粒子检测器实现的。
ToF分析提供了非常宽的质量范围,该范围仅受大分子物质检测灵敏度的限制。
MALDI-ToF-MS最多可以对数百万道尔顿的分子进行分析。微秒范围内的高传输效率和总飞行时间,为使用高重复率激光器进行高灵敏度表面检测提供了可能性。这使得高通量分析成为可能,而高通量分析正是大表面积样品分析的关键要求。
分辨能力的提高可以通过补偿解吸过程产生的初始动能来实现。
使用延迟提取,半球形静电扇形器件和反射镜等技术可以在m/z 1000下将半峰宽(FWHM)质量分辨率增加到m/△m = 30 000。用于化合物鉴定的串联质谱通常通过碰撞诱导解离(CID)或通过观察电离后亚稳离子的衰变实现。为此,两个独立的ToF系统可以以所谓的ToF / ToF配置串联。第一个ToF用于前体选择,第二个ToF用于产物离子分析。
傅里叶变换离子回旋共振质谱(FT-ICR-MS)是一种离子捕获技术,它决定了强磁场中潘宁离子阱中捕获离子的回旋加速频率。在外部离子源产生离子后,离子被转移到潘宁离子阱中,直到进一步分析。使用宽带射频电激发,所有离子被激发到大的回旋加速轨道。它们的轨道半径不仅增加,而在潘宁离子阱中,相同质荷比的离子也相互连贯地在轨道绕行。
在绕行期间,它们可以在一组双检测电极中引起振荡图像电荷。该时域信号被数字化并进行傅里叶变换以产生回旋加速频谱。质谱图可以通过对回旋加速器方程w=qB/m校准产生。
FT-ICR-MS的主要优点是具有无与伦比的质量分辨率和质量测量精度,可用于从MALDI图像分析中发现新的结构细节。此外,使用捕获离子技术不仅允许CID,而且允许红外多光子解离(IRMPD)和电子捕获解离用于串联质谱的结构测定。分析速度受观测时域信号的长度和相关质量分辨率的限制。质量分辨率取决于轨道离子的相干时间。典型的分析时间是每像素1 s,与所用的离子源无关。可以通过增加磁场强度来降低相同分辨率下的瞬态长度。MALDI组织成像实验可以在FT-ICR-MS系统上进行,FWHM分辨率范围从40000到400000。
通过MALDI生成离子的迁移分离,质谱图中可以得到更多附加信息。离子迁移谱是基于离子通过碰撞横截面面积的分离技术。在离子迁移质谱中,有充气的漂移池用于质谱分析之前的离子分离,这些离子由于构象或组成变化而具有不同碰撞截面。
当用于质谱成像时,除了空间维度和质谱维度之外,还增加了时间漂移的气相分离维度。离子迁移光谱法在两个主要方面有利于MALDI成像质谱的研究。
首先,增加额外的分离维度能够检测到更多的质谱峰。离子迁移有利于减小质谱分析复杂度,并有助于不同种类化合物的分离,例如肽和磷脂。第二,质量与漂移时间选择结合使得等压肽或其它类似物分解为分裂谱。
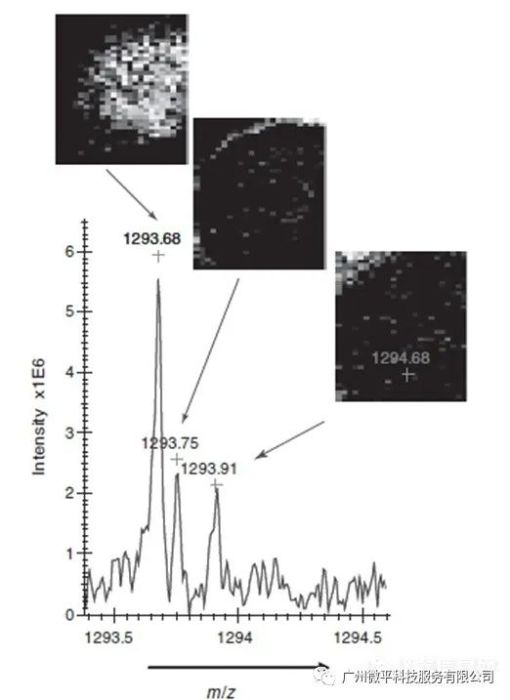
离子迁移、MALDI与用于IMS的ToF-MS组合,能够通过其相关的消化肽片段定位和鉴定蛋白质。离子迁移分离可以鉴定通过常规MALDI-ToF-MS无法鉴定的等压离子。与传统的MALDI-ToF相比,该方法每次测量的观察峰数量增加,能够产生质量和时间选择的离子图像,同时可以对单个离子进行鉴定。图3所示结果证明了离子迁移飞行时间成像质谱(IM-ToF-IMS)对来自组织的蛋白质鉴定的可行性。
组织消化与MALDI-IM-ToF-IMS方法相结合,可以对不同种类组织蛋白质鉴定实行“自下向上”的策略。
不同解吸电离方法与不同质量分析器组合,为在单个组织样品上进行互补实验提供了可能性。
需要仔细的实验设计来确保获得相关的互补分子图像信息。图中显示的实验工作流程提供了从单个组织生成六个补充图像数据集的示例。在该示例中,通过外科手术获得一块组织。组织中的细胞表达荧光标记的蛋白质,因此成像工作流程中的步骤是产生荧光图像。
这提供了一种特定蛋白质的详细位置。在将衬底表面上的10-20μm薄片进行组织切片和安装之后,进行SIMS分析。这提供了在高空间分辨率下的低分子量成像MS数据。静态SIMS除去表面材料的不到1%,因此残留的表面仍然可以进一步分析。SIMS研究完成后,可以用基质涂层覆盖组织表面(参见“基质涂层”一节)。根据感兴趣的分析物,表面可以或不能被洗涤。洗涤方案对所得结果有重要影响。
在图4的实验工作流程中,在基质沉积之前不进行洗涤以允许小的水溶性分子成像。在基质沉积后,进行的第一次分析是ME-SIMS。再次只有少量化合物分子从表面去除,晶体表面保持可用于后续的MALDI分析。ME-SIMS数据集提供了更大的完整有机分子(如脂质和分子量小于2000 Da的小信号分子)的信息。进行的下一个分析是具有略高于解吸阈值的激光注量的MALDI-ToF分析。
MALDI-ToF数据集包含有关内源性肽和完整蛋白的信息(取决于使用的洗涤方案和基质)。
可以获得的最后一个MS成像数据集是MALDI-FTICR-MS数据集(或离子迁移率图像数据集)。这些技术需要去除大多数基质材料。它们可以提供高质量分辨率和质量精度信息,有助于识别构成图像的分子。任何残留的基质材料都可以从多次分析的表面上洗去,以便进行最终的H&E染色。这提供了其他的组织学信息,可以与成像质谱数据集结合来鉴定特定区域或组织类型。
在MALDI和ME-SIMS分析之前,必须将基质溶液涂布于组织表面。基质溶液由有机溶剂如甲醇或乙腈组成,添加剂为弱有机酸如芥子酸(SA)或2,5-二羟基苯甲酸(DHB)和三氟乙酸(TFA)。加入TFA可增加分子的离子化质子的量。基质应用方法将强烈影响成像MS结果。应用方法将对灵敏度,表面扩散与空间完整性,空间分辨率,表面平坦度和分析速度产生影响。组织性质和环境参数影响组织中蛋白质的提取效率和基质的结晶。
因此,控制基质沉积环境也是很重要。有几个
正在考虑创新的沉积方法,如基质升华。对于一般
,一般有两种基质沉积方法:点样和喷涂。
将基质溶液点样到组织部分时需要将分析物的扩散限制在斑点大小范围。已经开发了两种基质检测方法:手动或自动检测。手动点样产生微滴液滴,经常用于不需要生成图像的MALDI组织分析。自动点样使用更小的体积(pl)液滴,并产生约120-150μm的点样尺寸和约200μm的最小分辨率。
两种不同类型的自动识别器用于基质沉积:喷墨式压电喷嘴和使用聚焦声波的液滴分配器。
两个喷射器都可以释放100μl在组织上干燥成150μm直径的液滴。在这种情况下,成像MS分析的分辨率通常会受到大于分析光束直径的基质点样点的限制。
基质喷涂使均匀小滴的基质溶液覆盖了样品的整个表面。气动、振动喷头或电喷雾可以使基质溶液变生液滴喷雾。喷涂可以手动和自动化的方式进行。手动喷涂采用手持气动喷枪或TLC喷雾器。通过喷雾装置与x-y机器人联用可以实现自动喷雾应用,也可以在较大的区域上进行基质沉积。
使用振动喷雾器在较小的区域也可实现自动喷涂,其小型腔室主要控制湿度。
喷涂后形成的晶体通常为10-20μm。为了获得更小的晶体,可以使用电喷雾,减小敏感度产生甚至小于1μm的晶体。当使用喷雾沉积时,激光束的直径限制了MALDI成像质谱的空间分辨率。
用于产生分子图像的质谱峰的识别是所有质谱图像策略中的关键步骤。选择时候,可以使用高质量分辨率以及准确的质量进行测量。通常需要结合其他策略,如使用MALDI串联质谱或其他分析策略来识别表面化合物种类。
串联质谱使用是识别表面产生的不同化合物离子的合理选择。限制因素是前体离子选择的分辨率、裂解效率和方法灵敏度。在相同的位置,通常只能进行几个质谱实验。
可以在单个位置进行的实验数量仍然取决于提供信号的激光照射的数量。
在相邻位置执行串联实验的隔行扫描成像方法可部分克服此问题。一旦裂解模式已知,可以应用多重反应监测来确定化合物分布。
研究可以使用互补组织匀浆和提取来产生组织成分的信息库。也可以使用LC-MALDI来解决混合物复杂性的问题,增加灵敏度,以及降低离子抑制效应。在直接MALDI成像实验中观察到的MALDI图谱比较分析可以用作识别策略的一部分。在这些研究中,串联MS可用于识别在LC-MALDI靶上发现的各个化合物成分。
(内容来源:广州微平科技服务有限公司 由小析姐整理编辑)












加载更多