干货分享| 酚氯仿法提取基因组DNA
提取细胞、组织的DNA进行PCR实验属于细胞分子实验的必备技能,现在各公司也开发了适用于各类样本的DNA提取试剂盒,省时省力。酚氯仿这种经典的实验方法正在被取代,但对于科研经费不是比较充足的 ,可能更愿意使用这种经典方法,从而使经费花在关键实验上。今天就为大家整理了该实验方法涉及到的一些内容。
实验目的
实验原理
操作流程
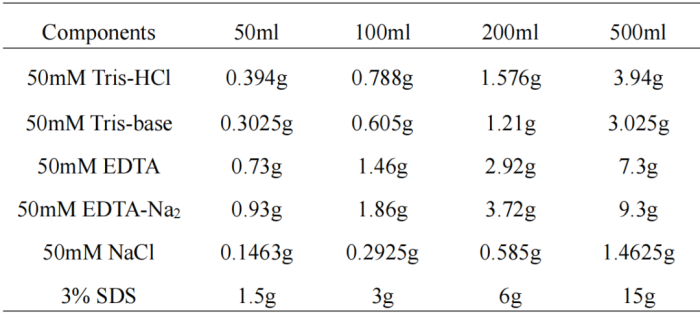
溶液配制
注意事项
相关问题
展源
何发
相关文章
-

DNA提取和定量的常见误区
2023-05-15
-

DNA提取及检测,这些细节你注意到了吗?
2024-02-23
-

DNA提取、含量及纯度的检测,这些细节你注意到了吗?
2021-11-18
-

DNA提取、含量及纯度的检测,这些细节你注意到了吗??
2024-01-10
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

DNA化学合成的应用
2020-09-07
-

红外光谱分析,你了解多少?
2021-01-11
-

三聚氰胺,你还要害多少人
2020-05-27

加载更多