四大板块帮你深入了解蛋白沉淀
1、蛋白沉淀的定义
沉淀是溶液中的溶质由液相变成固相析出的过程。蛋白质从溶液中析出的现象,称为蛋白质的沉淀。
2、蛋白沉淀前处理的优势与劣势
劣势:①此方法仅去除了蛋白质,内源性杂质并没有去除掉, 长时间检测可能会对 和仪器的寿命产生影响。所以, 要对 和仪器做定期维护。
3、蛋白沉淀常见问题
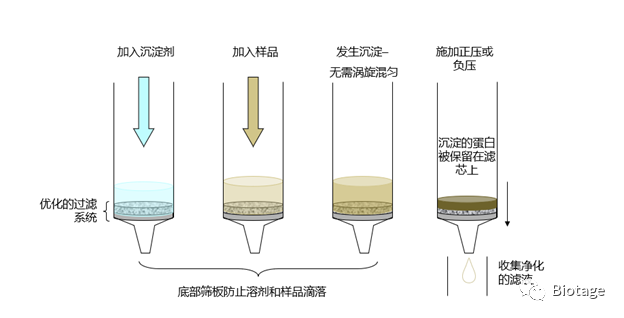
然而看似简单的流程,真正操作起来还是有一些令人“尴尬”的步骤,如:
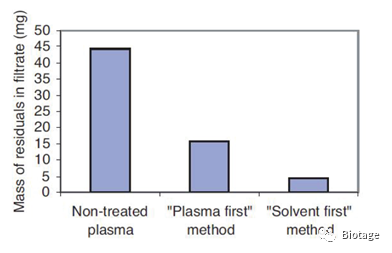
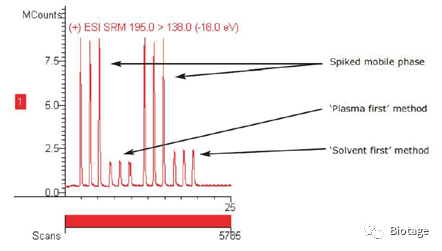
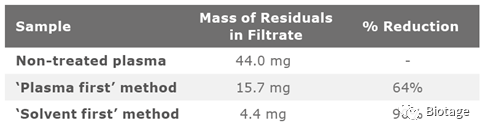 结果看到,样品先加模式去除了64%的内源性物质,而溶剂先加模式去除了90%的内源性物质,说明溶剂先加模式的蛋白沉淀效率更高,效果更好。
结果看到,样品先加模式去除了64%的内源性物质,而溶剂先加模式去除了90%的内源性物质,说明溶剂先加模式的蛋白沉淀效率更高,效果更好。
4、临床质谱领域蛋白沉淀方法汇总
1.有机溶剂沉淀法此方法为临床质谱领域最常用方法,一般沉淀试剂以甲醇、乙醇、乙腈为主。个别项目会在有机溶剂中加入一定量的有机酸来提高沉淀效率。例如同型半胱氨酸的检测,一般会在有机溶剂中加入一定量的三氟乙酸或者三氯乙酸。
适用目标物:生物小分子、糖类。
原理:有机溶剂的沉淀原理是降低水的介电常数,导致具有表面水层的生物大分子脱水,相互聚集,最后析出。
优点:①分辨能力比盐析法高,即蛋白质只在一个比较窄的有机浓度下沉淀;②沉淀后不用需考虑除盐,过滤较为容易。
2.盐析法当目标物为非蛋白质时,纯盐析法在临床质谱领域应用较少,因为沉淀后会引入高浓度盐,长时间进样的话会对仪器灵敏度和柱压产生影响。所以,一般使用盐析法沉淀后,样本还需经过稀释、减少进样量或者透析除盐等步骤。盐析法可与其他沉淀方法结合使用。
适用目标物:盐析法沉淀出的蛋白并没有失活,所以主要用于蛋白质和酶的提取。
3.加热凝固法原理:将接近于等电点附近的蛋白质溶液加热,可使蛋白质发生凝固( coagulation)而沉淀。加热首先是加热使蛋白质变性,有规则的肽链结构被打开呈松散状不规则的结构,分子的不对称性增加,疏水基团暴露,进而凝聚成凝胶状的蛋白块如煮熟的鸡蛋,蛋黄和蛋清都凝固。此方法主要选择性去除不耐热的杂蛋白。
适用目标物:目标物需要有较强的热稳定性,例如葡萄糖。
其余的蛋白沉淀法还有等电点沉淀法、非离子多聚物沉淀法、生成盐复合物沉淀法等,这些方法临床质谱领域应用较少,所以小编就不一一介绍了。感兴趣的小伙伴可自行了解。
目前常见的临床质谱项目中应用蛋白沉淀作为前处理的有药物检测(极大多数)、同型半胱氨酸、甲状腺激素、葡萄糖、水溶性维生素等。
展源
何发
相关文章
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

文献解读丨基于LC-MS/MS结合蛋白沉淀和杂质提取技术的奥曲肽临床药代动力学研究
2021-08-27
-

蛋白测序仪
2021-03-22
-

三聚氰胺,你还要害多少人
2020-05-27
-

培养基为什么出现沉淀?
2023-05-31
-
红外光谱分析,你了解多少?
2021-01-11
-
染色质免疫沉淀技术的应用
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06

加载更多