【干货】蛋白纯化的9大方法,一定要掌握!
蛋白质的分离纯化在生物化学研究应用中使用广泛,是一项重要的操作技术。蛋白纯化的方法很多,小析姐汇总了常用的9大方法,我们一起来看看吧。
层析技术早在1903年就应用于植物色素的分离提取,各种颜色的色素从上到下在吸附柱上排列成色谱,也称色谱分离法。1931年有人用氧化铝柱分离了胡萝卜素的两种同分异构体,显示了这一分离技术的高度分辨力,从此引起了人们的广泛注意。随着人们对层析技术的认识和实践的提高以及物理化学技术的发展,应用范围更加广泛,没有颜色的物质同样可用此法分离,这时的工作全是使用吸附剂的吸附层析法。自1944年应用滤纸作为固定支持物的纸层析诞生,层析技术的发展越来越快。20世纪50年代开始,相继出现了气相层析和高压液相层析,其他如薄层层析、薄膜层析、亲和层析、凝胶层析等也迅速发展。在生物化学领域里,层析技术已成为一项常用的分离分析方法。
层析法是利用不同物质理化性质的差异而建立起来的技术。所有的层析系统都由两个相组成:一是固定相,它或者是固体物质或者是固定于固体物质上的成分;另一是流动相,即可以流动的物质,如水和各种溶媒。当待分离的混合物随溶媒(流动相)通过固定相时,由于各组份的理化性质存在差异,与两相发生相互作用(吸附、溶解、结合等)的能力不同,在两相中的分配(含量对比)不同,而且随溶媒向前移动,各组份不断地在两相中进行再分配。与固定相相互作用力越弱的组份,随流动相移动时受到的阻滞作用小,向前移动的速度快。反之,与固定相相互作用越强的组份,向前移动速度越慢。分部收集流出液,可得到样品中所含的各单一组份,从而达到将各组份分离的目的。
按层析原理可将层析分为:
01
亲和层析
利用待分离物质和它的特异性配体间具有特异的亲和力,从而达到分离的目的。将可亲和的一对分子中的一方以共价键形式与不溶性载体相连作为固定相吸附剂,当含混合组分的样品通过此固定相时,只有和固定相分子有特异亲和力的物质,才能被固定相吸附结合,性无关组分随流动相流出。改变流动相组分,可将结合的亲和物洗脱下来。亲和层析中所用的载体称为基质,与基质共价连接的化合物称配基。具有专一亲和力的生物分子对主要有:抗原与抗体,DNA与互补DNA或RNA,酶与底物、激素与受体、维生素与特异结合蛋白、糖蛋白与植物凝集素等。亲和层析可用于纯化生物大分子、稀释液的浓缩、不稳定蛋白质的贮藏、分离核酸等。
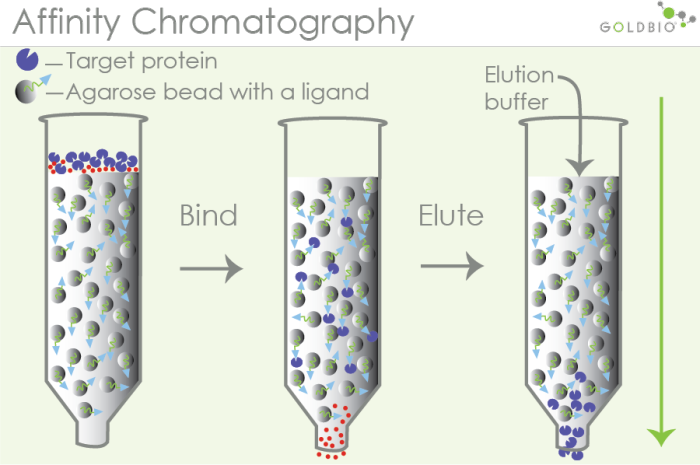
图1.亲和层析纯化的分离原理
特点:亲和层析具有高选择性、高纯度、快速、浓缩等特点,在重组蛋白的分离中多作为第一步的粗纯,实现对绝大部分杂质蛋白的去除。
02
离子交换层析
采用具有离子交换性能的物质作固定相,利用它与流动相中的离子能进行可逆交换的性质来分离离子型化合物的方法。主要用于分离氨基酸、多肽及蛋白质,也可用于分离核酸、核苷酸及其他带电荷的生物分子。不同蛋白质的等电点(pI,isoelectric point)特性,使在不同pH缓冲液条件下所带正/负净电荷不同,选择不同的离子交换柱实现分离。
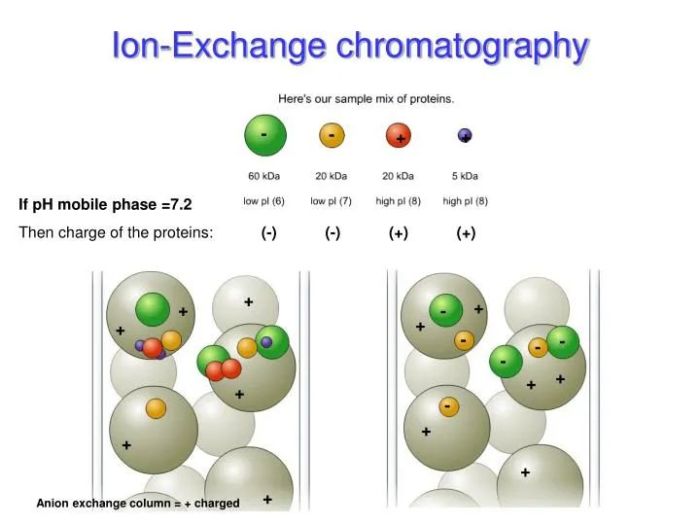
图2.离子交换层析纯化的分离原理
特点:离子交换层析属于吸附性分离方式,纯化过程中它具有可逆、操控性强及实现样品浓缩等特点。在精纯实验中是常与其它方法相结合使用的主要技术。
03
凝胶过滤层析
又称分子筛过滤或排阻层析等,根据大小和形状分离,这种分离方式是非吸附性的,整个分离过程中只需要一种缓冲液,实验操作方便医学教育网搜集整理固定相是多孔凝胶,各组分的分子大小不同,因而在凝胶上受阻滞的程度也不同。本法的优点是所用凝胶属于惰性载体,吸附力弱,操作条件温和,不需要有机溶剂,对高分子物质有很好的分离效果。常用的凝胶有Sephadex G系列。凝胶层析可用于脱盐、分离提纯、测定高分子物质的分子量、高分子溶液的浓缩等。在峰谱图中,出峰顺序是:大分子先流出层析柱,小分子后出。
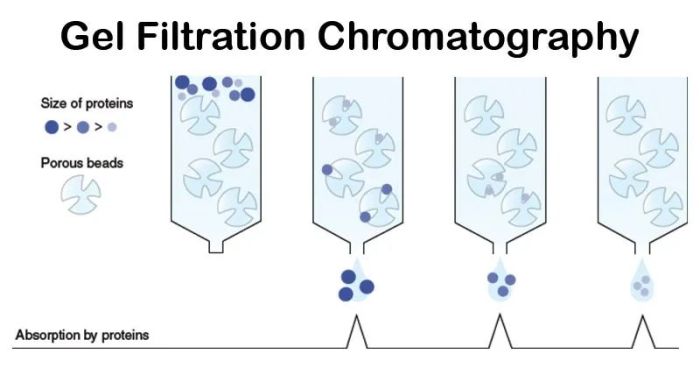
图3.凝胶过滤层析纯化的分离原理
特点:层析所用的凝胶属于惰性载体,不带电荷,吸附力弱,操作条件比较温和,可在相当广的温度范围下进行,不需要有机溶剂,并且对分离成分理化性质的保持有独到之处。对于高分子物质有很好的分离效果。
04
疏水相互作用层析
依据生物分子间疏水性差别实现分离的一种层析方式。高离子强度下,增进蛋白质中的疏水性氨基酸与层析介质间的疏水性相互作用,削弱其静电作用力。洗脱时,降低流动相离子强度,削弱蛋白质分子与层析介质间的疏水作用,实现目的蛋白的纯化和收集。
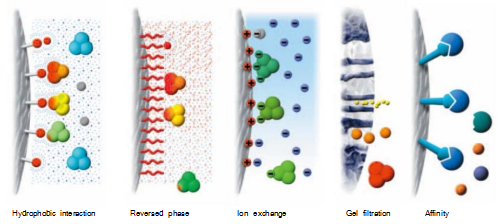
图4.疏水相互作用层析纯化的分离原理
特点:疏水作用层析也属于吸附性分离方式,对具有疏水特性的目的蛋白具有高选择性和浓缩等特点。疏水相互作用层析可以用于捕获、中度纯化或精细纯化阶段。由于样品应该在高些的盐浓度下来促进疏水相互作用,疏水相互作用层析很好的适用于在硫酸铵沉淀样品沉淀后的捕获步骤或在离子交换层析后直接进行中度纯化步骤。
05
反相层析技术
用反相层析分离生物分子依赖于洗脱液中样品分子和介质可逆的疏水相互作用。起始条件主要是水相的,有利于高度有序的水结构围绕着样品分子。通常的,一小部分有机修饰剂,通常是3%-5%的乙腈用来造成“湿”表面。样品结合到填料上,暴露给洗脱液的疏水区域最小化了。
分离依赖于样品分子在洗脱液中和填料表面达到的平衡。样品的分布依赖于填料的性质,样品的疏水性,洗脱液的组成(流动相),如图5所示。起初,条件有助于100%样品都结合在柱子上的极端平衡。由于蛋白和肽都有一些可及疏水和亲水氨基酸,而且相对的大,它们和填料的相互作用具有多点接触的性质。
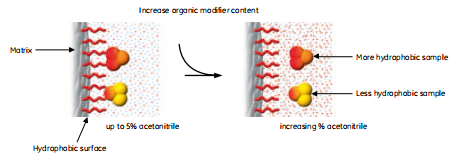
图5.在水样条件下结合在反相层析介质上的蛋白和多肽被洗脱后变得更加疏水
特点:反相层析可以在活力和四级结构回收不重要的情况下,对于复杂混合物给出极高的分辨率的分析性分离。反相层析有高分辨纯化的能力,也具有低分辨脱盐的能力。在纯化步骤中,当在大部分杂质已经被除去,而需要高分辨的分离相似组分时,反相层析最适合精细纯化阶段。
06
高效液相层析(HPLC)
在经典液相层析法基础上,引进气相层析的理论而发展起来的一项新颖快速的分离技术。具有分离能力强、测定灵敏度高、可在室温下进行、应用范围广等优点,对分离蛋白质、核酸、氨基酸、生物碱、类固醇和类脂等尤其有利,根据流动相和固定相相对极性,高效液相色谱分析可分为正相和反相两种。
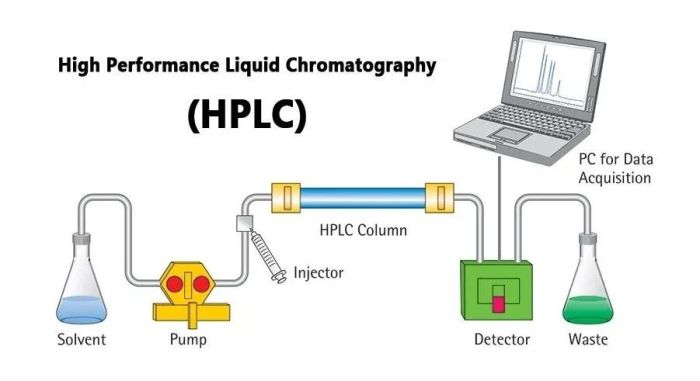
图6.高效液相层析纯化的分离原理
特点:用高压输液泵,压强可达5000psi(相当于34个标准大气压)。用直径约3~10微米的超细支持物装填均匀的不锈钢柱。常用的支持物是在玻璃小珠上涂一层1~2微米的二氧化硅,经硫酰氯反应生成Si—Cl,进一步连接疏水的烷基,如Si—C18H37,或阳离子交换基团—Si(CH2)n—C6H4SO3H,或阴离子交换基团—Si(CH2)nNH2。这种支持物能承受很高的压力,化学性能稳定。用不同类型支持物的HPLC,可做吸附层析、离子交换层析和凝胶过滤层析。其分析微量化可达10-10克水平。但用于制备,可以纯化上克的样品。展层时间短,一般需几分钟到10余分钟。其分析速度、精确度可与气相层析媲美。HPLC适于分析分离不挥发和极性物质。而气相层析只适用于挥发性物质,两者互为补充,都是目前最为理想的层析法。HPLC配有程序控制洗脱溶剂的梯度混合仪,数据处理的积分仪和记录仪等电子系统,成为一种先进的 ,在生物化学、化学、医药学和环境科学的研究中发挥了重要作用。
07
吸附层析
指混合物随流动相通过固定相时,由于吸附剂对不同物质的不同吸附力,而使混合物分离的方法。它是各种层析技术中应用最早的一类,至今仍广泛应用于各种天然化合物和微生物发酵产品的分离、制备。
吸附层析可以是薄层层析,也可以是柱层析——即蛋白纯化系统使用的纯化方式。硅胶通常用于薄层层析——将不同颗粒度的硅胶用水调成糊状铺于玻璃板上,后经高温烘干。硅胶也可用于柱层析。硅胶主要是用于疏水性物质的分离,在蛋白质化学中不常使用,但可以用于小分子多肽的分离和分析。磷酸钙凝胶与硅胶相反,基本上只用于柱层析,主要用于蛋白质等大分子的分离,对某些酶类的分离呈现很好的效果。
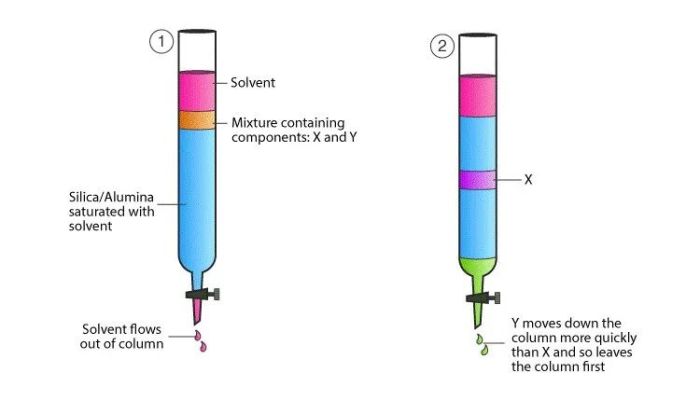
图7.吸附层析分离原理
特点:吸附层析常用于浓缩样品。一些浓度很稀的样品,在特定的条件下吸附在层析柱上,而后突然地改变条件,将被吸附的样品一起从吸附柱上洗脱下来,这样所得的样品的浓度可以提高很多。
08
分配层析技术
各物质在两相中扩散速度不同,产生不同的分配系数。分配层析分离技术是利用各物质不同分配系数,使混合物随流动相通过固定相时而予以分离的方法。分配层析中应用最广泛的是以滤纸为多孔支持物的纸上分配层析。其次是以硅胶、硅藻土、纤维素粉、淀粉、微孔聚乙烯粉等多孔支持物的分配层析。还有直接使物质在两种不相溶的溶剂中进行分配的常压液相分配层析和高压液相分配层析。分配层析以分配系数为依据,在o等温等压条件下可用下式表示。K=K2/K1,式中K为分配系数;K2是物质在固定相中的浓度; K1是物质在流动相中的浓度。分配系数与温度、溶质和溶剂的性质有关,各种物质有不同的分配系数。
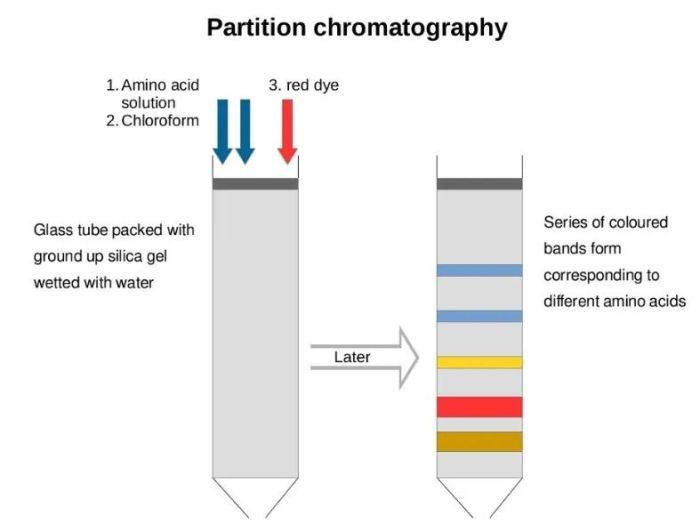
特点:分配系数是指一种溶质在两种互不相溶的溶剂中的溶解达到平衡时,该溶质在两相溶剂中所具浓度的比例。不同物质因其性质不同而有不同的比例,也就是有不同的分配系数。现在应用的分配层析技术,大多数是以一种多孔物质吸着一种极性溶剂,此极性溶剂在层析过程中始终固定在此多孔支持物上而被称为固定相。另用一种与固定相不相溶的非极性溶剂流过固定相,此移动溶剂称为流动相。如果有多种物质存在于固定相和流动相之间,将随着流动相的移动进行连续的、动态的不断分配,由于各种物质的分配系数相近,移动距离就必须相当长才能分开。反之,两种物质的分配系数相差越大,彼此分开时的移动距离就越短。因此,必须根据实际情况,选定作为固定相用的层析柱或滤纸的长度。
09
鳌合层析
在生物分子中亲水的部位也经常可以彼此形成氢键和其他配位键,鳌合层析就是基于这个原理。在一些基质上接有亚氨基二乙酸等具有配位能力的分子,这样的介质就能螯合锌、铜、铁等离子,而这些离子的配位价还未饱和,为此离子还可以与蛋白质等生物分子形成配位键。不同生物分子形成的配位键的强度各异,从而可起到分离纯化作用。
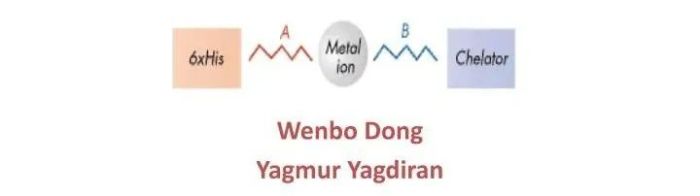
特点:这类层析不仅可以分离纯化转铁蛋白和铜盐蛋白等含有金属的蛋白质,也可分离不含金属的蛋白。
结语
蛋白纯化过程受蛋白本身理化性质影响,技术人员理论及经验很大程度上也决定了纯化成功与否,实际操作中可根据实验需求及 具备的条件选择合适的纯化方法。
参考文献:
1.疏水相互作用层析和反相层析
2.本文部分内容整理自互联网
内容来源:医药速览
转载平台:医药速览
展源
何发
相关文章
-

His标签蛋白纯化问题解析
2022-02-18
-

蛋白纯化的三种新工具
2020-05-27
-
全自动离线二维LC纯化蛋白
2020-05-27
-

蛋白纯化方法看看有你不会的吗?
2021-12-17
-

【干货】蛋白纯化9大方法,赶快收藏!
2024-01-26
-

师兄不愿告诉你的蛋白纯化经验(含避坑清单)
2022-02-24
-

干货 | 蛋白分离纯化搞不定?看这里!
2022-09-05
-

【实验必备技能】蛋白纯化的四种方法 17/64
2022-12-23
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27

加载更多