检测限、定量限、报告限、忽略限有什么区别?
一、定义与释义:
检测限Detection Limit(限度试验):试样中被测物质被检测出的最低量。从定义来看这一指标只能用于限度检查,而不能进行报告定量结果。
定量限Quantitation Limit(定量试验):试样中被测物质被定量测定的最低量,其测定结果应符合准确度和精密度要求。(也是成线性范围的最低浓度或量),可衡量方法灵敏度与定量检测能力。
报告限(Reporting Threshold):高于此限度的降解产物需报告其含量。法规要求大于该限度必须报告的,是基于质量可控性的科学性和严格性的平衡。
忽略限Disregard Limit:字面理解,低于此限度的杂质可直接忽略不计,执行层面可理解为低于此限度的单个杂质可不报告,可不计入杂质总和。
二、如何获得检测限、定量限、报告限?
定量限与检测限是对于分析方法的检出能力和灵敏度的测试,需经方法验证而得。
1、检测限:通常的做法是配制一个溶液,通过稀释获得信噪比≥3:1的溶液作为定量限(日常为了方便稀释与计算、以及看检测限与定量限的对应关系,通常可先做定量限,然后用定量限溶液再稀释为检测限)。
常见问题:方法验证中,检测限的信噪比大于10:1,是否还能将这个水平当做检测限?
当然不能,既然信噪比已经大于10:1,也就说明可以准确定量了,为什么还要当做检测限,可能会导致一些杂质不被报告。
2、定量限:通常的做法是配制一个溶液,通过稀释获得信噪比≥10:1的溶液作为定量限。也可直接用一定浓度的溶液直接进样,信噪比>10:1即可。例如,报告阈值为0.05%,则可直接使用≤0.05%对应的溶液进样,查看信噪比符合即可。
3、做检测限和定量限要点和注意事项
(1)选择待测物质附近(前、后)基线平滑的基线,时间持续1min左右即可,但是需要注意6针中的同一成分的选择时间应保持一致(日常工作中可能部分不理解定量限考察意义的人员会选择远离待测成分的基线,选择时段可能也不一样的情况)
(2)一定要是连续进样,通常建议LOQ进样6针(因其要符合准确度和精密度要求),LOD进样3针。
(3)LOQ信噪比6针均要≥10:1;LOD信噪比均要≥3:1
(4)ICH(Q3A、Q3B)中分析方法描述:定量限应不大于(≤)报告限”,故有关物质方法验证/确认中进行定量限试验时,需要提前计算一下该药品的日服用剂量,然后从ICH指导原则中看一下报告限是多少,验证/确认结果一定要与法规上的报告限进行对比,定量限不能大于报告限。
(5)如与CRO公司合作等,在接收、审核资料时也要注意。(常见问题,人员方法验证作出的定量限大于ICH中的报告限)
(6)因检测限、定量限除了方法的灵敏与否之外,受仪器性能影响较大。做检测限与定量限时,注意要考虑到不同性能、不同品牌仪器的差异,一定不能刻意去挑选性能和灵敏度非常好的仪器进行试验。
(7)为便于数据应用及撰写资料方便,每针单独计算信噪比(报告中需要报出);计算出定量限/检测限浓度,如0.0502ug/ml,同时计算出定量限/检测限(相当于供试品浓度的百分比)=定量限/检测浓度/供试品浓度。
4、报告限:根据药品的日服用剂量,详见ICH指导原则(附图1),其余见“五、报告阈值
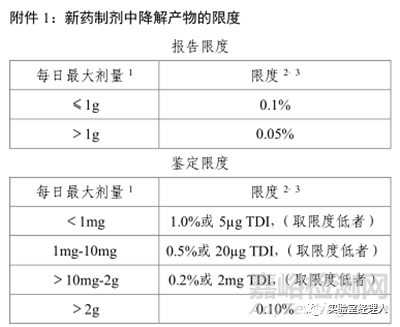
三、检测限、定量限、报告限之间的关系是什么?
ICH中规定定量限≤报告限,检测限又小于定量限,从而推得3者的关系:检测限<定量限≤报告限。
聊到这里,可能有人着急了,那他们和忽略限的关系呢?不要着急,欲知关系如何,且听下节分析。
四、聊聊“忽略限“?
说实话,这一节的标题老王想了又想,觉得还是没有合适的标题,只能对”忽略限“先画个问号,再逐步聊聊为什么。因为忽略限这个名词在EP或USP中会见到,中国药典则会描述为:“小于对照溶液XX倍的色谱峰忽略不计。”
USP在2022年01月份发了一个关于“USP通则<621>色谱法-重要标准协调”的通告,其中有一条” 术语"可忽略限度(Disregard limit)"被"报告阈值(Reporting thresholds)"取代“的内容,计划于 2022年12月1日起正式生效。此内容老王甚是赞同,因为实际工作中有的叫做”忽略限“,有的叫做”报告限“,搞得分析人员一头雾水,到底各自有什么作用?互相有什么关系?又有什么不同?怎么描述怎么叫才合适呢?
其实,不论是叫做“忽略限“还是”报告限“,他们的目的是一样的,叫做“忽略限”,那么就是低于这个限度的杂质可以不报告,等于和高于这个限度的杂质需要报告;叫做“报告限”吧,等于或高于此限度的杂质就需要报告,低于此限度的杂质可不报告。
所以日常工作中,建议参考USP通则<621>色谱法中描述为报告阈值(Reporting thresholds)较为合适,就避免了人员纠结到底是忽略限呢还是报告限呢……
五、如何建立每个品种的“报告阈值“呢?
USP还在2021年发了一个关于“报告限”去留的内容,其中说了FDA在多个药品各论修订意见中建议删除各论中的“报告限“,美国FDA认为药典各论无法对所有生产企业的每一个杂质或降解产物进行鉴定和罗列,那么各论中设定“报告限”可能会导致产品中某些高毒性杂质不被鉴定或报告。另外,美国FDA认为每个药物有其各自的特性,“报告限”应当因产品而异,企业应当在药物申请时做出说明,美国FDA也会参考ICH的报告限作为指导原则,对不同产品进行不同的考量。它是让用户基于药物特性、最大摄入剂量等因素自主选择“报告限”策略。USP则在接到美国FDA的意见后,开展了一系列工作, 后续可能在修订时删除已生效各论中的“报告限”,并通过凡例的形式对“报告限”的选择提供指导规范。
老王期待着指导规范的发布,当然我也从质量控制与确保药物的安全性角度考虑,建议大家建立各自产品”报告阈值“时,除了考虑ICH中的报告限,基于药物的安全性、如服用剂量等,杂质概况,还可考虑方法的灵敏度综合制定。通常建议可用方法验证得出的定量限作为该产品的报告阈值,即能确保杂质结果准确定量,又不高于ICH中的报告限,而不建议直接用ICH中的报告限直接作为报告阈值。
六、检测限、定量限、报告阈值如何应用?
方法验证完成后,可将检测限(LOD)、定量限(LOQ)应用于后续的Sop编写中,对分析人员合理报出检验结果具有指导意义。通常:
1、定量限的应用:
(1)可参考其制定”报告阈值“
(2)大于定量限的,即能够准确报出结果的直接报告数值即可。小于定量限的,可以报告小于定量限(<LOQ),同时可将LOQ备注出来。
结果报告示例:RRT约为1.8的杂质<LOQ(0.03%)。
2、检测限的应用:
(1)很多小伙伴对于积分参数的设置存有很多疑惑,那么,如果你做了检测限,则可参考检测限设置最小峰面积等制订合理的积分参数,低于检测限可不进行积分,避免过多的杂峰或基线波动干扰;大于检测限的色谱峰则积分、计算(积分、计算是为了分析杂质变化趋势用)。
(2)可用于指导结果报告。如果检测数据较小,小于检测限,则可报告小于检测限(<LOD)同时可将LOD备注出来。例如,RRT约为0.8的杂质<LOD(0.01%);对于小于检测限的情况也可报告为未检出,具体按照哪种方式报告,需要在各自管理文件中作出明确规定。
3、报告阈值的应用:
前边说了为了分析各杂质的变化趋势,对于大于检测限的杂质要积分、计算,那么是否需要报告呢?则需要视情况而定。若杂质含量超过可以报告的限度(如定量限、报告阈值)则可报告出单杂及可计入总杂质。(来源:药事纵横)
经理人
展源
何发
相关文章
-

检测限与定量限概念解析
2020-05-27
-

检测结果在检出限和定量限之间,该如何出具报告?
2024-01-16
-

区分检出限、测定限
2023-06-27
-

【收藏】检出限、测定限、最佳测定范围
2024-04-30
-

八一八食品分析中的检出限和定量限
2020-05-27
-

检出限、测定限,如何分清这“两限”?
2023-05-10
-

仪器最低检测限到底怎么做?
2020-05-27
-

溶出度实验、测定方法验证
2020-05-27
-

Hamilton稀释仪在药物溶出度检测中的应用
2020-05-27

加载更多