流式单细胞样本制备概述及精选案例分享(组织篇)
Q
组织样本有哪些呢?
新鲜实体组织,来源小鼠的淋巴结、脾脏、肝脏、肿瘤、肺、肠道等;
石蜡包埋组织
Q
组织流式样本制备的原则是什么呢?
最大的单细胞得率
细胞结构完整性和抗原性
Q
新鲜实体组织流式样本制备的流程
操作流程为:新鲜组织----组织分散----过滤、离心、洗涤----细胞悬液,组织分散是最关键的步骤。
Q
组织分散的方法有哪些呢?
手术剪刀剪碎组织,用锋利的解剖刀剁碎组织或用匀浆器制成组织匀浆,再用细注射针头抽吸细胞后用300目的尼龙网滤出单细胞悬液;采用网搓法也能获取大量细胞。
化学处理法的作用原理:是将组织细胞间起粘连作用的钙﹑镁离子置换出来,从而使细胞分散下来。(胰酶+EDTA)
操作流程:
①将组织切成薄片放入试管,加入0.2% EDTA液5ml,室温,半小时,弃之;
②加入(0.125%胰酶+0.2%EDTA液)5-10ml,37℃水浴30分钟,间断振荡3-5次;
③用300目尼龙网过滤,离心沉淀1000rpmm,5分钟,再以生理盐水洗2-3次,离心500-800prm,1-2分钟;
④70%乙醇固定置冰箱中待检。
酶对实体组织分散作用原理主要有三方面:
①破坏组织间的胶原。
②水解组织细胞的紧密连结装置的蛋白性物质。
③水解组织间的粘多糖物质。
酶的种类:
胰蛋白酶;胶原酶;溶菌酶;弹性蛋白酶等。
不同酶对细胞内和细胞间不同组分有特异作用,故要根据分散组织类型来确定使用的酶类 。
用于实体组织消化的主要酶是胶原酶(胶原蛋白水解酶):
它能在生理pH和温度条件下特异性地水解天然胶原蛋白的三维螺旋结构,而不损伤其它蛋白质和组织。
胶原酶的四种基本类型:
①胶原酶I型:各种酶成分均衡,用于上皮组织、肝、肺、脂肪和肾上腺组织样本,可用于获取淋巴细胞;
②胶原酶II型:较高的梭菌肽酶A含量,通常用于分解心脏,骨,肌肉,甲状腺和软骨瘤组织;
③胶原酶III型:低蛋白水解酶活性,普遍用于乳腺组织;
④胶原酶IV型:多种蛋白酶成分,能消化多种组织。低胰酶活性,通常用于消化胰岛细胞以及对细胞表面受体完整性有较高要求的实验样本。
酶学方法的一般程序:
①将适合于酶消化的组织置于离心管中。
②将选好的酶溶液1-2ml加入盛有被消化组织的试管中。
③一般消化20-30分钟(恒温37ºC或室温),消化期间要间接振荡或吹打。
④终止消化,收集细胞悬液,以尼龙网(200目)过滤,除去大团块,以低速离心除去细胞碎片。
⑤将制备好的单细胞进行流式细胞术分析或保存。
胶原酶的类型、含量、buffer怎么选择呢?
给大家推荐一个特别实用的网站:http://www.worthington-biochem.com/tissuedissociation/working.html
相信我,总能找到你需要的!
示例如下: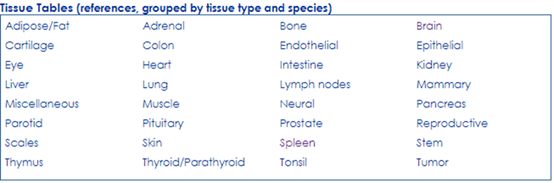
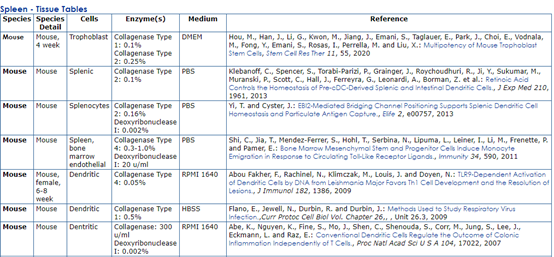
点击表格里的任一组织,如Spleen,出现如下表格,你想要的,应该都有。
Q
组织分散各方法的优缺点?
机械法常造成严重的细胞损伤、单细胞产量低、碎片过多、影响检测结果,但对于富于细胞的组织——淋巴肉瘤、视神经母细胞瘤、脑瘤、未分化瘤、髓样癌以及一些软组织肉瘤等,往往用单纯的机械法就可以获得大量高质量的单分散细胞;建议使用物理研磨方式,可以使抗原得以完整保留。对于不易研磨的组织,可先采用酶消化,再配合研磨进行;
化学处理法的处理组织导致细胞存活率低,细胞产量较低,细胞碎片和细胞聚集量不稳定,此方法可单独使用,也可与其他方法结合使用;
酶学法、化学法对实体组织的分散解聚较理想,但对所检测的化学成分有不良影响。
了解了各组织分散方法,下面来看几个实例(采用机械法+胶原酶处理法):
单细胞悬液制备操作流程如下:
将肿瘤组织剪成泥浆状后,均分到六孔板中,每孔加入2 ml 消化液(5%DMEM培养液 + 胶原蛋白酶I (工作浓度:1 mg/ml) + 脱氧核糖核酸酶I (工作浓度:200 μg/ml)),于37 °C恒温细胞培养箱消化30 min,每隔10 min将六孔板取出晃动混匀一次。注意严格按照时间消化,以免影响免疫细胞活性。可根据肿瘤大小调整消化液的用量。
消化完毕后,将六孔板取出放于冰板上,每孔加入4 ml DMEM高糖培养基 (含5% FBS) 终止消化。用70 μm细胞滤网过滤,同时用1 ml注射器后部研磨遗留在滤网上的组织块 (注意研磨时切勿用力,易将脂肪等带入细胞悬液中),用DMEM高糖基础培养基冲洗滤网上的组织块,所得肿瘤悬液4 °C,850 x g,离心5 min。
设门方式 (图3):成熟标志:CD86。
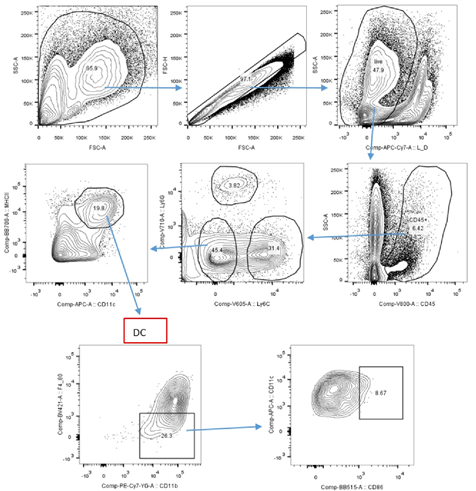
图3:小鼠肿瘤内DC的设门方式
单细胞悬液制备操作流程如下:
获取肺组织后剪碎至2-3mm,加入2ml含 1型胶原酶/DNase I 消化液(胶原酶:5mg/ml DNase I 1 mg/ml),37℃、125rpm 消化30min。
用18号针头5ml注射器将消化后的组织抽出并排出两次,最后抽出过75um筛子,如果还有大块组织的话用2ml注射器活塞在75um筛子上轻轻研磨,置于含1ml 0.5%BSA的预冷PBS的离心管里重悬。
于 300g,4℃ 5min离心弃上清加入2ml ACK 裂解液 4min 裂解红细胞。收集裂解后的单细胞重悬。
肺组织样本细胞分型设门策略 (图4),可识别上皮细胞、内皮细胞、造血细胞系和谱系阴性细胞。
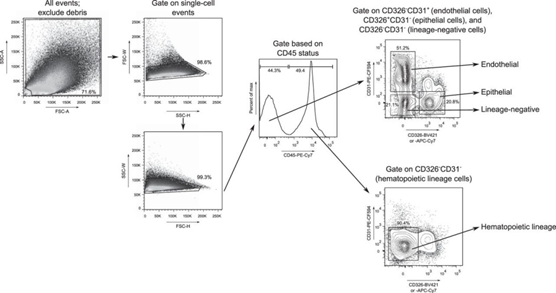
图4:肺组织样本细胞分型设门策略
单细胞悬液制备操作流程如下:
将采集到的小肠和大肠组织分成2cm左右的小段分别用PBS、含1 mM DTT的PBS 、含30 mM EDTA 、PBS重复清洗。
消化一根小肠需要5 ml含有150 μg/ml DNase I及100 U/ml collagenase VIII的1640完全培养基。消化一根大肠需要5 ml含有150 μg/ml DNase I和200 U/ml collagenase VIII的1640完全培养基。用镊子取出清洗过的肠道组织,置于装有消化液的六孔板中 (每孔加5 ml消化液),再分别剪成0.5 cm左右的小段,在37 °C,5% CO2浓度的CO2培养箱中静置消化90 min,转移到干净的15 ml离心管中,剧烈振荡3~5 min,待组织摇碎后,消化液及摇碎的组织经70 μm滤膜过滤。
收集含有细胞的滤液,400 x g室温离心5 min得到细胞沉淀。
现用现配40% percoll和80% percoll用于密度梯度离心。800 x g室温离心20 min,升速 (ACC) 1,降速 (DEC) 0。离心结束后,吸取中间层淋巴细胞至10 ml PBS中,上下颠倒混匀,800g、室温离心10min,弃清后得到细胞沉淀重悬。
固有淋巴样细胞根据其表达转录因子和分泌细胞因子的特征主要分成三个亚群,ILC1、ILC2、ILC3。固有淋巴样细胞主要居留在粘膜组织中,其中肠道固有层存在大量的ILC1、ILC2、ILC3。图5和图6分别展示了大小肠中固有淋巴样细胞的亚群分布,比较两图可知,大肠中的固有淋巴样细胞以ILC2为主,而小肠中的固有淋巴样细胞以ILC3为主,还观察了ILC2表面CD25的表达情况,发现肠道ILC2均高表达CD25。
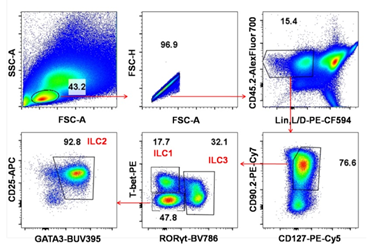
图5 小鼠大肠固有层固有淋巴样细胞亚群分布
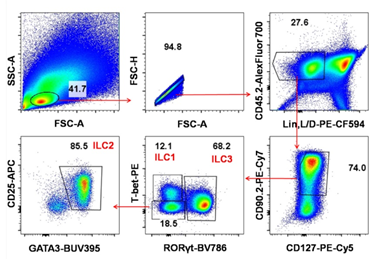
图6 小鼠小肠固有层固有淋巴样细胞亚群分布
Q
石蜡包埋组织样本制备的意义及方法?
外科手术获得的实体组织,大部分经过石蜡包埋处理。石蜡包埋组织单细胞分散方法的建立,扩大了流式细胞术的应用范围。
操作步骤:
①石蜡包埋组织在切片机上切取40-50μm厚的组织片3-5片。
②将切取的组织片放入试管中。
③加入二甲苯5-8ml脱蜡(在室温下),1-2天,视石蜡脱净与否,可更换一次二甲苯,蜡脱净后弃去二甲苯。
④水化:依次加入100%、95%、70%、50%梯度的酒精5ml,每步10分钟,去乙醇,加入蒸馏水3-5ml,10分钟后弃之。
⑤消化:加入2ml 0.5%胃蛋白酶(pH值1.5-2.0)置37℃恒温水浴中消化30分钟,消化期间每隔10分钟振荡一次。
⑥消化30分钟后,立即加入生理盐水终止消化。
⑦经300目尼龙网过滤,未消化完的组织片可以二次消化。
⑧收集细胞悬液,离心沉淀1500prm,以生理盐水漂洗1-2次,离心沉淀1500prm,再以生理盐水漂洗1-2次,离心沉淀500-800prm,去碎片。
注意事项:
一定将石蜡从组织中脱干净,检验是否将石蜡脱净的方法是,弃去二甲苯,加入100%乙醇,如无絮状物浮起,即视为石蜡已脱净,反之则没有脱净。
消化时间不可过长,以免造成已释放出的细胞核被消化掉。
切片不可过薄或过厚,过薄则碎片增多,影响流式分析结果,过厚造成脱蜡不净或脱蜡时间过长,一般以40-50μm为宜。
流式细胞术的样本制备并没有一个黄金标准!最佳样本制备方法需要根据具体情况独立设定评估!
以上就是本篇的全部内容,希望对大家有所帮助!
参考文献:
1. Yang,C., Jin, J. S. and Deng, L. F. (2019). The Detection of Dendritic Cell Subsetsand Maturation in the Tumor Microenvironment by Flow Cytometry. Bio-101:e1010310. DOI: 10.21769/BioProtoc. 1010310.
2. JasonR. Mock, Franco R. D'Alessio, Neil R. Aggarwal.(2016)Flow-cytometric method forsimultaneous analysis of mouse lung epithelial, endothelial, and hematopoieticlineage cells. PMID: 26944088 PMCID: PMC4867353 DOI: 10.1152/ajplung.00334.2015.
3. Zhang,J. J. and Shen, L. (2019). Classification and Phenotype Analysis of MouseIntestinal Innate Lymphoid Cells (ILCs). Bio-101: e1010327. DOI:10.21769/BioProtoc.1010327.
科享家
展源
何发
相关文章
-

流式血液样本制备——献给初学者
2023-11-21
-

简化样本制备的微波系统
2020-05-27
-

增塑剂分析时前的样本制备
2020-05-27
-

液体处理系统提供了更好的样本制备
2021-01-12
-

Nature重磅:我国干细胞制备技术获重要突破!
2022-04-15
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

Nature子刊:杨义豪等揭示癌症是如何转动干细胞命运的齿轮
2023-08-09
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

流式细胞仪使用方法
2020-05-27

加载更多