补料分批法的优化控制
补料分批法的优化控制
开发异源蛋白制备工艺,需要进行大量的平行培养试验,大多是在震动瓶中或者微孔板上来进行批次培养。所面临的重要挑战则是如何对培养条件进行控制。为达此目的我们采用了现代化传感技术以及统计学的实验设计—DoE最佳实验设计。
在生物工程领域,小到毫升级别,大到工业生产规模级别,为缩短生产过程的开发时间,进行实用的方法开发是其前提条件。本文的研究中,采用了统计学的实验设计(DoE),按照两种不同的培养规模微升级和毫升级,求出最佳培养参数。
通常分批培养法都是在震动体系(主要是震动瓶,也包括微孔板和台式发酵仪)中进行的,旨在以较小的耗费来获得实验结果。可惜这里并未考虑到生产规模的条件及其对于产品的收率和质量的影响。
究其原因就是:
培养是分批次进行的,工业化的生物过程在原则上也属于一种基底限制的补料分批培养过程,其碳料的加入和其pH值的演变也受到控制。
培养中没有考虑浓度梯度的影响,尤其是在大比例的放大过程中,由于搅拌装置效率受限而可能引起的浓度梯度。
在 规模的批次培养中,碳源在起始阶段呈现为高浓度,许多细菌的数量是以指数的方式生长形成有机酸,致使pH值随时间发生变化。对于溶解氧而言,可能在震动瓶局部形成梯度。此外,在震动瓶中进行的培养没有明显出现介质组成的浓度梯度。微孔板如同震动瓶一样具有局限性,所得到的附加信息很少的,这是因为对于这样小体积的取样和精确分析是很有限的。
非常重要的一点就是,对于每种培养规模(微孔板、瓶、微反应器、工业化规模的大反应器)
而言,都要能够知道其结果所具有的说服力边界是什么。
此外开发可靠的数学计算和分析方法以及监视和控制的方法也很有意义,以便获得不同发展阶段中较为准确的信息。
本文进行了补料分批培养法按照两种不同规模:采用24式微孔平台(3.3ml)和震动瓶(125ml)分别进行培养比较。运用了presens precising sensing有限公司的传感器技术,能够对两种培养规模的pH值和溶解氧(DO)进行监测(见图1)。依此建立起微升和毫升级规模间的数学关系,以微孔板培养中所获得的数据为基础,按照此前所确定的最佳实验条件,移植到震动瓶或发酵仪中再进行后续试验。此举目的在于利用小规模的培养同时获取更多附加信息。这样一来,可以降低之后的任何放大尺寸规模的试验次数。
材料与方法
为了在微孔板上和震动瓶中进行这种基底限制的补料分批培养试验,采用了Anbase系统(Biosilta公司)。此系统是从溶解的聚合物中将葡萄糖通过生物催化释放出来。培养过程中葡萄糖的摄入量是通过加入催化剂的量测得,微孔平台或是震动瓶中培养时达到最大生长点时,释放葡萄糖所需的生物催化剂其最佳体积和理想浓度值就是以上试验的测定目的。
借助软件Modde 9.1(Umtrics)确立采用的参数值:生物催化剂的浓度(0-30 U/L)和体积(在24孔板中为0.5~2.1ml,在震动瓶中为7~15ml);最佳密度为波长600nm时测得。取不同体积和催化剂浓度以不同的规模共进行了11次试验。这种24孔氧盘(Oxodish)和水盘(Hydrodish) 配备有SDR传感器测量系统(Presens公司)。而震动瓶(总体积125ml)则配备有通过SFR Shake Flask 读出装置的pH值、溶解氧值监测传感器。传感器盘和孔板是通过特殊的盖子和钳具的结合来获得氧气。
此外为了对两种规模的pH值、溶解氧进行在线测量,对于细菌的生长采用了分光光度法于600纳米波长进行测量(OD600)。凭借这种补料分培养法,成功实现了大肠杆菌BL21在Enpresso B 介质中的培养(Biosilta)。这种培养的起始光密度OD600介于0.1 – 0.3之间。在培养的全程时段中,其pH值和溶解氧值的饱和度不仅能够在微孔板中而且也在震动瓶中受到连续监测,借以评估养条件,进而保证细菌的培养得以在pH 7 – 7.5之间和不会出现氧气限制的条件下生长。为此要在规律的时间间隔将样品取出进行光度法测量。
微孔板对照震动瓶
正如从图2中所见,所有溶解氧的进程对于基底限制的补料分批培养法而言均是特征性的。在每项试验中,生物催化剂的活性大致上都是保持一致的。这样反过来又导致葡萄糖的供给对于整个培养过程也都是大致相同的。在第一阶段,由于低的细胞密度,限制了葡萄糖的吸收,导致葡萄糖的富集和细菌首次的指数式的生长阶段。这也如多数工业化生产所期待的那样。细菌呼吸频率的强烈增加并伴以指数式的生物聚集体的增长,可以明显地体现于溶解氧(DO)曲线的加速下降中。pH-值的下降,表明了细菌排泄产生了有机酸,主要为乙酸。第二阶段则是以基底限制为特征的。过剩的葡萄糖已被耗尽,细胞的生长和呼吸的速率,对于每一培养方法而已,都是通过葡萄糖的释放速率加以测得的。葡萄糖浓度的开始下降,不仅是在SDR抑或SFR体系中,对于每一种培养而言,均是与释放葡萄糖的生物催化剂的量有关的。通过对葡萄糖加入剂量的优化,可以调节葡萄糖释放的速率,使之在培养过程中不至于出现厌氧阶段(见图2 A-C)。如同所期待的那样,氧的转移在震动瓶中要比在微孔板系统中进行得更好,所以能够将震动瓶中催化霉的浓度从4提高到23U/L,而并不出现缺氧的情况。在微孔板的SDR系统中出现的趋势,可以在震动瓶的SDR-系统中加以重现。相似的情况还出现于两种培养系统中的溶解氧和pH-的曲线廓形(见图2 D-F),证实了培养的重现性。介于不同凹穴和不同培养之间的差异,从统计学上看,没有什么意义(数据未予展示)。

图1.于一震动器上所结合的Shake-Flsk读数器和传感器盘读数器。
总结
氧和pH-的测量,对于生物生产的培养过程中生理状态的监控是不可或缺的。如果能够提供一种可能性,将溶解氧的饱和度和pH-值在采用微孔板和震动瓶中扫描试验的培养过程的早期就予以监测,这对于较快地进行生物过程开发而言,当是一种重要的贡献。将这种测量系统结合于适合的控制方略和基于先进模式的试验设计,则能够通过少量的试验,以微小的人力和物力的耗费,取得进行有效的扩大试验所需要的基础性数据。如果细胞培养能够在有氧的、基底限制的和pH-稳定的条件下进行的话,那么这种小规模试验与大规模生产之间的相关性就会增加。 规模有控制的补料分批培养法,不仅能够获得较高的细胞密度和产率,而且还能得到大规模生产条件的较大近似性。结合基底脉冲技术,在本文的研究中业已能够将工业规模的异质条件复制出来,使得细胞培养免于不断交替地处于基底不足或者基底过剩的区域。
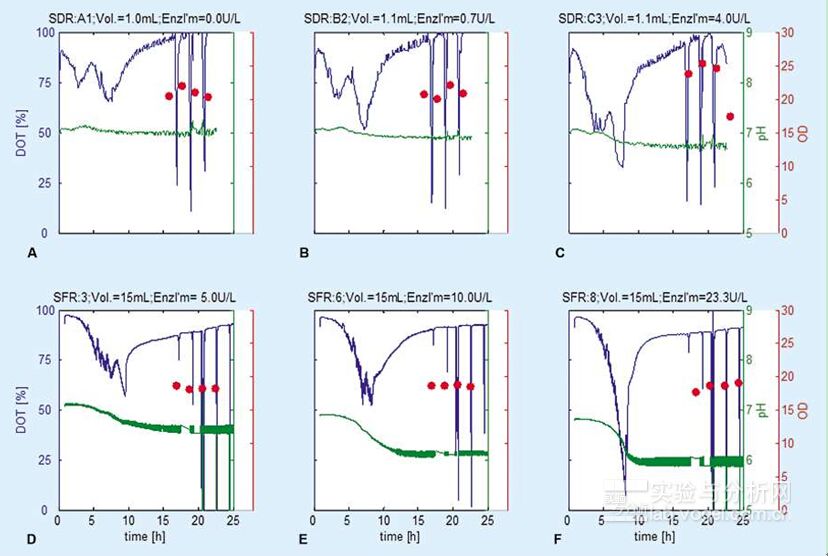
图2.大肠杆菌BL21培养过程的在线监测:(A-C) 在微孔板中pH值和溶解氧的测量;(D-F) 在震动瓶中pH值和溶解氧的测量。
更加快捷的生物过程开发
如果能够提供一种可能性,将溶解氧的饱和度和pH-值在采用微孔板和震动瓶中扫描试验的培养过程的早期就予以监测,这对于较快地进行生物过程开发而言,当是一种重要的贡献。将这种测量系统结合于适合的控制方略和基于先进模式的试验设计,则能够通过少量的试验,以微小的人力和物力的耗费,取得进行有效的扩大试验所需要的基础性数据。
实验与分析
展源
何发
热点文章
-
【干货】革兰氏染色的原理、步骤、误区及结果判读!
2025-09-28
-
【干货】如何进行氢氧化钠溶液的标定!
2025-10-14
-
【细看】常见26种试剂的危害与防护!
2025-09-29
-
【必看】 安全分类分级你都了解了吗?
2025-11-17
-
【谨记】 安全“四不”要牢记!
2025-11-10
-
危险源如何辨识?!
2025-09-22
-
紫外杀菌灯的原理、使用及维护
2025-10-31
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来 媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多