李斯特菌检测技术应用概述
国内外李斯特菌检测及其快检技术的发展
本文比较分析了国内外李斯特菌的检测方法、不同标准限量值的差异。介绍了国内外李斯特菌快速检测技术的应用及存在的问题,对我国微生物快速检测的现状进行了概述,探讨了李斯特菌快速检测技术的未来发展方向,对李斯特菌检验方法探索及快速检测技术的发展具有一定的借鉴意义。
李斯特菌(Listeria spp.)广泛存在于环境中,并且在很多食品有检出,该菌在低温的条件下仍能存活和增殖,其中单核细胞增生李斯特氏菌(Listeria monocytogenes)是食源性疾病的主要致病菌之一,也是食品安全控制的重要病原体,感染后会造成不同程度的人员死亡,受到各国的高度重视。传统方法检测费时费力而灵敏性较差,因此,快速、高效、灵敏可信的检测方法能够更加有效判定李斯特氏菌污染风险并且控制其危害。
李斯特菌的污染及危害
李斯特菌在环境中普遍存在,也是污染食品的主要病原菌,往往侵染肉类、蛋类、禽类、海产品、乳制品、蔬菜等食品。其中,单核细胞增生李斯特氏菌(Listeria monocytogenes)是食源性疾病的重要病原菌, WHO将其列为21世纪四大食源性致病菌之一。单核细胞增生李斯特氏菌广泛存在于土壤、人和动物的粪便中,在4℃的环境中仍能生长繁殖,是冷藏食品中主要的病原菌之一,往往污染食品导致食源性疾病的暴发。近年来,单核细胞增生李斯特氏菌引起的食源性疾病事件时有发生,并造成不同程度的人员死亡,受到各国的高度重视。
国内外李斯特菌限量规定
李斯特菌极容易污染食品,其中冷藏食品和即食食品危害最为严重,各国均制定了食品中李斯特菌的限量值和监测计划。美国对即食食品中单增李斯特菌的限量规定为0/25g,并要求企业实施GHP和HACCP。中国大陆2013年颁布的《食品中致病菌限量标准GB29921-2013》中规定,在即食肉制品中,单增李斯特菌按照二级采样方法取样不得检出(n=5,c=0,m=0)。
李斯特菌主要检验方法
目前,食品微生物检测体系主要包括,中国的国家标准(GB4789)和检验检疫行业标准(SN)、国际化标准化组织(ISO)方法、美国食品药品监督局(FDA)、美国农业部(USDA)、美国官方分析化学师协会(AOAC)、加拿大健康保护部(MFLP)、欧盟食品安全局(EFSA)等检测体系。
食品中单增李斯特菌(Li. monocytogenes)的传统检测方法主要包括增菌、分离和鉴定3 个环节。目前,分离环节常会采用显色培养基,使其菌落颜色不同于其它干扰菌,实现快速分离。鉴定常采用生化反应和血清学反应。目前,生化反应的鉴定技术多采用数值分类鉴定和自动化检测技术。
表1.单增李斯特菌不同检测体系介绍
方法名称 |
一次增菌 |
二次增菌 |
分离 |
鉴定 |
快速方法 |
||
GB/T 4789.30-2010 |
PALCAM (36±1℃,24-48h) |
动力试验;染色镜检(革兰氏染色、典型运动);生化特性(MR-VP、糖发酵);溶血试验;协同溶血;或生化鉴定试剂盒或全自动微生物生化鉴定系统 |
无 |
||||
LB1 (30±1℃,24h) |
LB2 (30±1℃,18-24h) |
||||||
FDA |
BLEB+Phy (30℃,4h) |
BLEB+Phy+三种抑菌剂 (30℃,20/44h) |
OXA/PALCAM/MOX/LPM+七叶灵+Fe3+ 推荐BCM /ALOA / RapidL'mono /CHROMagarListeria |
蓝色菌落*;典型运动或动力试验;过氧化氢酶;革兰氏染色;溶血试验;硝酸盐还原*;糖发酵;协同溶血;血清学检验;小鼠毒力试验* |
筛选、鉴定都可以使用快速方法 |
||
ISO 11290-1(E) |
半量Fraser肉汤 (30℃,24±2h) |
Fraser肉汤 (35或37℃,48±2h) |
OXA和PALCAM (30、35或37℃,24-48h,) PALCAM平板微需氧或好氧条件培养 |
蓝色菌落*;过氧化氢酶;革兰氏染色;动力试验或典型运动*;溶血试验;糖发酵试验;协同溶血;送参考 (血清或噬菌体分型) |
无 |
||
李斯特菌快速检测技术
传统方法检测费时费力操作要求高,因此,李斯特菌快速检测技术和产品的开发是必要的。美国、欧盟等发达国家对微生物快速检测方法的研究和产品认证体系相对成熟,各种不同的快检系统和自动化仪器被推出,并得到广泛的应用。当前,李斯特菌快速检测方法为增菌以后,生化鉴定之前,对样本进行快速筛选,以缩小检测范围,减少检测任务,提高检测效率。快速检测方法主要包括酶底物显色技术、免疫学和分子生物学检测三大类。
即用培养技术 即用培养基技术则省掉了前期准备工作,可以直接检测样品,从而节约了大量人力成本。目前,商业化的固定培养基技术主要有两种:纸片法和即用平皿法。纸片法是指将显色培养基固定于纸片上,上方再盖一层带有方格的透明薄膜,以方便计数。即用平皿法是指用已倒有培养基的平皿,接种操作与传统涂板、划线法一样。其优点和纸片法一样,即省掉了前期准备工作,可以直接接种培养。此类产品主要有3M的Petrifilm试纸片、良润生物的MicroFast®测试片、北京陆桥的Easy test 系列产品及绿洲生化的微生物测试片等,已被许多研究被证明与传统方法的检测结果无显著性差别。
免疫学检测法 该技术以抗原抗体免疫为基础,制备特异性克隆抗体检测细菌。目前国内外李斯特菌快速检测的此类技术主要包括:酶联荧光分析法(ELFA)、金标免疫层析技术、流式细胞技术等。ELFA 灵敏度比ELISA 高,并省去了ELISA 中的颜色反应,缩短反应时间;但缺点是成本较高,目前主要应用在自动酶联荧光免疫检测系统(VIDAS)上【6】。金标免疫层析技术是将高度特异性抗单增李斯特菌抗原的抗体束缚在色原载体上,且可与固相支撑基质相分离。当检测样品中存在李斯特菌时,测试单元的试剂将会被展开,产生肉眼可见的确定性反应。流式细胞术是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段[6],它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数。该检测技术平均1min 即可得到检测结果,无需培养和样品制备,灵敏度可以达到1~100CFU,但仪器投入较大,检测成本相对较高,对样本的要求高,严重的制约这该技术在食品微生物检测中的应用。
分子学检测方法 主要包括核酸探针杂交技术、PCR 检测技术等。DNA 探针法是将2 条碱基互补的DNA 链在适当的条件下杂交,通过检测样品与标记性DNA 探针之间形成的杂交分子来检测样品中的单增李斯特菌,测定放射性或荧光强度即可得出样品中单增李斯特菌的个数[7]。PCR 是近年来广泛应用的分子生物学检测方法,在单增李斯特菌的检测中以其遗传物质高度保守的核酸序列(常用的靶序列包括hly、actA、prfA等)设计引物进行扩增。该方法特异性好,但灵敏度低,对样品进行前处理后再进行扩增,可以提高检出率和检测灵敏度。国内外目前主要应用的PCR技术包括:实时荧光PCR(Real-time PCR)、多重PCR、恒温扩增、RT-PCR 方法、IMS-PCR 检测技术等[8]。
增菌快速检测技术
不管是国标GB方法还是ISO、FDA等方法,李斯特菌检测必须经过2次增菌后再进行分离鉴定,操作比较繁琐,操作过程容易造成污染,且耗时较长。MicroFast®李斯特菌快速增菌培养基为一步增菌培养基,即在检测扩增李斯特菌的过程中不需要二步增菌,因此操作性更方便。具有如下优点:
对培养基进行增菌检测
在450个食品样本中添加一定量李斯特菌,建立感染模型,分别用FM快速增菌培养基和国标法规定对培养基进行增菌检测,结果发现FM培养基对李斯特菌复苏效果显著,尤其是检测冰激凌、奶酪类产品,具体对比如表2所示。
表2. MF培养基与国标培养基在实际样本检测中的效果
样本 |
接种水平 CFU/25g |
FM快增培养基 |
国标法检出 |
|
金标卡法检出 |
培养法检出 |
|||
肉类 |
5 |
19 |
19 |
18 |
冰淇淋 |
8 |
20 |
20 |
3 |
牛奶 |
3.5 |
34 |
36 |
32 |
奶酪 |
3.5 |
19 |
21 |
15 |
海鲜、生鱼片 |
2.8 |
45 |
45 |
45 |
检出总数 |
137 |
141 |
113 |
|
检出率(总共450样本) |
30% |
31% |
25% |
|
扩增速度更快速
通过实验间比对李斯特菌在四种不同培养基中的生长速度,发现李斯特菌在MicroFast®培养基(以下称MF)中具有最快的生长速度,图3表明李斯特菌在MF培养基的生长速度均优于LB1、BLEB和UVM培养基,进口BLEB培养基优于UVM及LB1培养基。
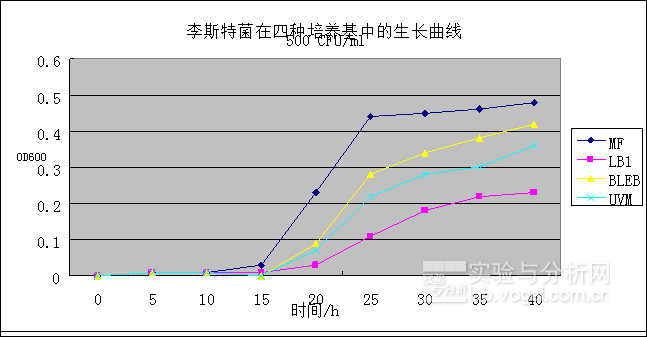
图1.李斯特菌在不同培养基中的生长曲线。
具有更强的选择特异性
通过实验测试,该培养基可以抑制绝大多干扰菌的生长(1/115,即115株非李斯特菌种仅有1株能够生长)。图4说明了李斯特属的菌在FM培养基中都能正常生长,而主要干扰菌菌不能在MF培养基中生长,尤其是乳酸杆菌的抑制,对提高发酵乳中的李斯特菌检出作用明显。
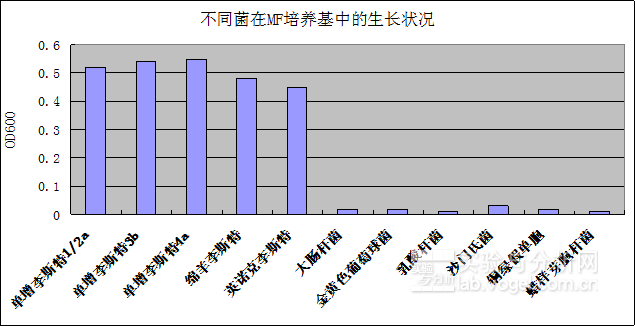
图2.不同菌在MF培养基的生长状况
小结
微生物检测包括前处理、增菌、富集、检测等环节。为实现快速、实时、准确的监测食品微生物,每个环节都应有相应的筛查技术及产品。我国在微生物快速检测技术的应用及技术研发方面相对欧洲国家比较落后,快速检测技术的发展和应用需要政府相关机构、科研单位、企业共同的努力建立一套快速、准确、简单的检测体系,此外,还需要降低检测成本,提供检测灵敏度和实用性,这些是今后微生物快速检测的发展趋势。
北京良润生物科技有限公司
展源
何发
热点文章
-
【干货】革兰氏染色的原理、步骤、误区及结果判读!
2025-09-28
-
【干货】如何进行氢氧化钠溶液的标定!
2025-10-14
-
【细看】常见26种试剂的危害与防护!
2025-09-29
-
【谨记】 安全“四不”要牢记!
2025-11-10
-
【必看】 安全分类分级你都了解了吗?
2025-11-17
-
危险源如何辨识?!
2025-09-22
-
紫外杀菌灯的原理、使用及维护
2025-10-31
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来 媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多