仿制药中有关物质研究(连载一)
本文在总结多年审评仿制药研发资料经验、长期从事药品检验的感受及药品品质评价法与临床疗效间的相关认知等基础上,详尽阐述了进行仿制药研发时有关物质的研究思路,宏观地解读了药物临床使用时杂质的副作用。
现今,有关物质研究已成为仿制药研发的重中之重。自2007年我国修订《药品注册管理办法》以来,国家药品审评中心发布了大量有关物质研究指导原则,各国药典、进口质量标准也对有关物质制订了翔实充分的质控指标。近年来,国内注射剂不良反应事件层出不穷,众人也将杂质归结为主要因素之一。基于以上背景,杂质研究成为了业内关注的焦点。
制订有关物质检查项的原则
原料药质量标准
原料药质量标准通常需制订。即便该原料药稳定性良好,在效期内杂质无任何增加/变化,质量标准中也应制订有关物质检查项。此举是通过对合成工艺杂质的控制与评估,来保证批次间原料药生产稳定性与质量均一性。
制剂质量标准
应研究“原料药制成0天制剂”和“0天制剂在效期内流通”两个环节的杂质变化情况。若一个环节有变化,就需拟定有关物质检查项;而均无变化可不拟定。
杂质谱研究逻辑树
目前,全球药品研发皆提出了“杂质谱研究”理念,仿制制剂与原研制剂剂型不同时可参照该思路。由于临床使用的是制剂,仿制制剂的降解杂质通常与原研制剂相同,而仿制原料药的工艺杂质与原研原料药可能不一致,因此无需对各国药典原料药质量标准项下罗列的所有杂质逐一研究,仅关注其中与制剂相同的降解杂质即可。
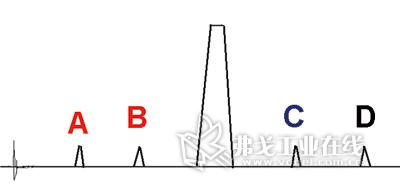
图1. 原研制剂杂质谱测定结果。
购买数批原研制剂
无论是仿制药研发还是品质评价,皆应获取至少3个不同时间段批号的原研制剂,并最好有近效期的样品,以知晓该时间点时杂质的降解情况和含量。随后,取最新批号样品进行加速或长期试验,进一步观测杂质降解情况和增长速率,同市场流通样品做综合比较分析。仿制药研发工作建议在原研品上市后启动,一年购买1个批号,测定其多条溶出曲线和杂质谱,并观测近效期时这些指标的变化情况,以更科学合理地指导届时自我仿制品的开发工作。
六类/五类仿制药研发思路
解读既有质量标准
针对此类仿制药研发,建议查询所有可及的制剂与原料药质量标准;着重关注制剂质量标准,解读试验条件、杂质种类、杂质质控限度等,原料药的质量标准应着重关注与制剂相同的主成分降解杂质。
研发时仅是借用既有质量标准的检测色谱条件和目标降解杂质限度值,至于杂质种类和个数等是根据自我仿制品的研发实际情况针对性地研究和拟定。不同生产单位可能会采用不同的原料药制备工艺、制剂的处方工艺,从而导致产品质量控制方法的不同。需遵循仿品种而非仿标准的原则,以研制产品与已上市产品安全性、有效性一致为目标,针对具体品种制定个性化注册标准。
实践既有色谱条件并予以优化
建议采用25cm普通 ,以更有效增强分离效能。不推荐使用超高速液相,因该试验所受干扰因素较多,难重现,不便推广。对于反相色谱检测,可适当减少有机相比例,使主成分保留时间延长、各峰分离度增加,或至检出的杂质数不再增加。供试品溶液的主成分保留时间推荐在15~30min间,全部检测时间约在45~90min。既可将各种杂质尽可能分离,又可通过调整峰宽与斜率,使保留时间较长的杂质峰即便展宽也可积分出,不会导致漏检。
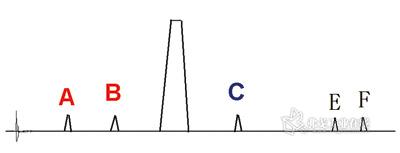
图2. 仿制原料药和仿制制剂杂质谱测定结果。
流速与柱温以满足上述保留时间为宜,流速无需拘泥于0.8~1.2ml/min间;柱温略高于室温,有利于延缓 使用寿命。仪器配置推荐具有自动进样装置的色谱仪。梯度洗脱时流动相配制最科学方式为A相为高比例水相-低比例有机相,B相为低比例水相-高比例有机相;其次是A相为高比例水相-低比例有机相,B相为纯有机相。
梯度洗脱程序皆可灵活地更改,如延长洗脱时间、调整最终两相比例、延缓每分钟变化率等,已达到分离自我样品的目的。采用最终优化的色谱条件,能够将仿制原料药/制剂的各工艺杂质/降解杂质/辅料干扰等与主成分良好分离。此时的系统适用性试验用溶液应将杂质:主成分配制成1:100浓度来验证专属性。同时,还应进行强制降解试验,用以验证各种强破坏试验条件下,主成分与产生杂质的分离检测结果,应特别关注DAD检测条件下主峰纯度,如不纯,则应适当调整色谱条件参数,将杂质分离出,无需检测杂质峰纯度。
测定原研制剂杂质谱
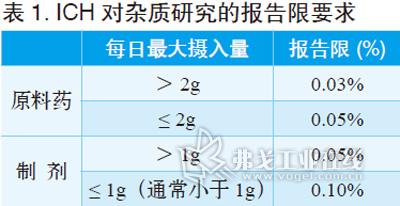
在对供试品溶液积分时,其中一项重要参数就是最小峰面积的设定,即杂质报告限,ICH在原料药与制剂中杂质研究指导原则中规定如表1所示。
除非既有质量标准中有低于0.05%限度的杂质要求,通常可根据以上规定予以设定。如仅进行仿制制剂研发,建议积分限度设定为0.10%;如要同时进行仿制原料药研发,遵循杂质谱研究逻辑树,建议将积分限度设定为0.05%。这也同时考虑了方法学中最低检测限和最低定量限等指标的验证。
杂质测定结果的记录保留到小数点后两位即可,在上述条件下测定原研制剂杂质谱。如未能获得临近效期的样品,可采用最新批号样品进行影响因素试验,还应进行加速试验以观测杂质变化情况,尤关注不断增加的杂质。往往在加速试验3个月时,便可初现端倪。测定结果如图1所示。
杂质A和B随时间延长、含量不断增加;加速试验也证明,结果分别为0.15%→0.50%和0.20%→0.68%,故确定为主成分降解杂质。经核对原研制剂质量标准,通过相对保留时间定位推算确定为某代号杂质;再根据既有质量标准,知晓两杂质限度分别为0.7%和1.0%(数字皆为举例、以下同)。杂质C和D随时间延长、含量不变化;加速试验也证明不增加,故推断为主成分原料药工艺杂质或辅料峰。检测结果分别在0.33%~0.35%和0.07%~0.08%间波动。
测定仿制原料药杂质谱
美国FDA发布的《仿制制剂杂质研究指导原则》中指明:ICH在新原料药与新制剂中杂质研究指导原则中的许多建议完全适用于仿制药研究,故积分限度参照“最小峰面积的设定”项下依据设定为0.05%。测定结果如图2所示。
对于杂质A和B,研发要求3批样品0天时的含量不应高于原研制剂起始点含量(即0.15和0.20%),加速试验证实不断增加,但增加速度不高于原研制剂,且未超出限度值。杂质C经研究确证为合成中间体、即合成工艺中引入的杂质。研发要求3批样品0天时的含量不大于原研制剂,加速试验证实不增加。杂质D未检出,说明该杂质为原研制剂特有杂质,勿需研究。对于仿制原料药中特有杂质E和F,3批样品0天时含量均分别为0.12%和0.07%。经验证,杂质E为合成中间体杂质,因合成路径与原研原料药不同,加速试验证实不增加;杂质F增加、为新增降解杂质,但至加速试验6个月时未超出0.2%。
根据表2,由于以上两杂质均不过0.1%就无需鉴定;但考虑到最终临床使用的是制剂,故可再根据制剂要求,放宽至0.2%(或0.5%,以下同)。即仿制原料药中的特有杂质只要最终含量未超过0.2%(主成分日剂量10mg~2g),即可不进行结构确认等的进一步研究。
当特有杂质量超出0.2%,建议对原料药合成工艺进行完善与优化,减少含量至鉴定阈值以下,否则就需进行结构确认→定量检测→甚至动物毒理试验推算该杂质限度值的深入研究。
如研发制剂涉及的原料药为外购时,制剂生产企业可要求原料药企业按既定色谱条件检测,若达不到要求,应进行精制优化,直至符合规定。
测定仿制制剂杂质谱
测定结果如图2所示。对于杂质A和B,研发要求三批样品0天时的含量不应高于原研制剂起始点含量,加速试验证实不断增加,但增加速率不快于原研制剂,且最终时间点含量未超出既有质量标准的限度值。
对于杂质C,要求结果同仿制原料药,加速试验证实不增加。由于原研制剂在该杂质含量的前提下临床已应用多年,安全可靠,且含量未超过原研制剂,故仿制制剂与原料药就无需再深入研究该杂质。推荐采用液质联用色谱仪做一定性试验予以验证,或用两种以上色谱系统验证为同一物质即可。杂质D未检出,同仿制原料药。杂质E和F的研发要求为加速试验证实杂质E不增加。杂质F增加、但至加速试验6个月时未超出0.2%。由于均未过鉴定限,故无需进行结构确认等进一步研究。
实验与分析
展源
何发
热点文章
-
【必看】 安全分类分级你都了解了吗?
2025-11-17
-
【谨记】 安全“四不”要牢记!
2025-11-10
-
气相色谱法科普知识
2025-11-18
-
【必看】1分钟看懂qPCR曲线图
2025-11-27
-
应该怎么用?9步搞懂!
2025-11-12
-
【小知识】 单位换算!
2025-12-22
-
【必看】生物安全 分类
2025-12-18
-
安捷伦在中国:加速本土创新与绿色发展的双重推进
谈及2024年安捷伦大中华区的业绩表现,杨挺表示,尽管在2023年和2024年全球经济增速放缓,安捷伦中国的业绩仍稳步增长,尤其在制药、食品、环境等行业展现出强劲的市场需求。未来,随着中国科技创新和绿色发展政策的持续推进,安捷伦将继续深化在中国的布局,进一步推动本土化创新。 总结 2024年安捷伦媒体沟通会不仅展示了安捷伦在液相色谱领域的创新成果,也体现了公司在中国市场的深耕与战略部署。
作者:张明
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来 媒体圆桌会成功举办
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多