高效液相色谱-串联质谱法测定食品中丙烯酰胺的残留量
丙烯酰胺是一种白色小分子结晶状固体,分子量 71.08,熔点85℃,室温下稳定,易溶于水、甲醇、乙醇、丙酮、氯仿等溶剂,是不饱和酰胺类小分子物质。食品中的丙烯酰胺是由天门冬酰胺和还原糖在高温下发生美拉德反应生成,因此含有上述2种物质的高温加工食品易被丙烯酰胺污染。人体可通过消化道、呼吸道、皮肤黏膜等多种途径接触丙烯酰胺。大量的研究表明丙烯酰胺对人和动物不仅具有神经毒性,还具有一定的致癌性、致突变性和生殖毒性。
目前,食品中丙烯酰胺的检测方法主要有气相色谱-质谱法(GC-MS)、高效液相色谱法(HPLC)和高效液相色谱-串联质谱法(HPLC-MS/MS)等。GC-MS法需要衍生化处理, 操作过程繁杂,样品处理操作周期较长,不适用于大批量样品的处理。HPLC法受杂质干扰大,紫外检测灵敏度低。HPLC-MS/MS法综合了高效液相色谱的色谱分离能力和质谱的高灵敏度,使其具有较低检测限,并且操作简单无需衍生化,适合大批量样品的检测。因而被更多研究人员所采用。本研究采用高效液相色谱-串联质谱法检测丙烯酰胺在薯片、饼干、锅巴等食品中的含量,考察提取条件以及净化方式对检测灵敏度的影响,并优化液相色谱、质谱条件,对所建立的检测方法进行评价,旨在建立一种高效的丙烯酰胺含量检测方法。
实验部分
主要仪器与与试剂
仪器:UltiMate 3000超高效液相色谱仪(配TSQ ENDURA质谱检测器),美国赛默飞世尔公司;Atiantis T3 ,美国Waters公司;Vortex3涡旋混合器,德国IKA公司;T18均质器,德国IKA公司;Centrifuge 5810R离心机,德国Eppendorf公司;Turbo Vap LV氮吹浓缩仪,美国Caliper公司;XP205电子分析天平,德国梅特勒-托利多公司;Milli-Q超纯水器(Advantage-10/Elix),美国Millipore公司。
试剂:丙烯酰胺(99.3%),德国Dr. Ehrenstorfer公司;13C3-丙烯酰胺1 mg/mL,(甲醇溶液,1 mL),上海安谱;乙腈、甲醇、甲酸(色谱纯),美国Fisher公司;Oasis PRiME HLB(60 mg,3 mL)美国Waters公司;其他试剂均为分析纯。
材料:薯片、面包、锅巴、饼干等淀粉类食品(均购于西安市场)。
标准溶液配制
标准储备液:准确称取丙烯酰胺标准物质10.00 mg,用甲醇定容至10 mL,使丙烯酰胺浓度为1.0 mg/mL。
标准使用液:吸取适量标准储备液,定量稀释,分别配制成浓度为0.1、1、10 µg/mL的丙烯酰胺使用液。准确吸取13C3-丙烯酰胺标准物质1.00 mL,用甲醇定容至10 mL,使13C3-丙烯酰胺浓度为100 µg/mL。上述标准溶液均于-20 ℃冰箱中保存。
标准系列溶液(0.1%甲酸水配制):取定量合适浓度的标准使用液配制成13C3-丙烯酰胺浓度为1 µg/mL,丙烯酰胺浓度分别为0、5、10、20、50、100、200、500 ng/mL的系列标准溶液。
样品前处理
称取2 g(精确至0.01 g)已经粉碎均匀的样品,加入0.1 mL(1 µg/mL)内标溶液,加入20 mL甲醇充分涡旋混合,振摇30 min 后,于4000 r/min离心10 min,取上清液待净化。取10 mL提取液,直接上载至PRiME HLB固相萃取柱,收集流出液,氮吹浓缩至近干,用0.1%甲酸水溶液定容至1 mL,用0.22 µm的滤膜过滤。滤液待UPLC-MS/MS测定。
液相色谱及质谱条件
色谱条件: 为Waters Atiantis T3(2.1 mm×100 mm,1.7µm)。流动相为甲醇-0.1%甲酸水(体积比5:95),等度洗脱;流速0.2 mL/min,进样体积10 µL,柱温30 ℃。
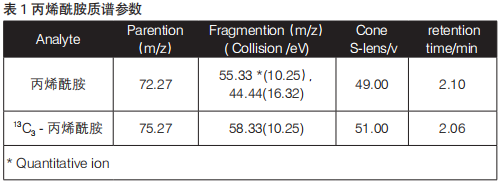
质谱条件:电喷雾正离子模式 ESI(+)扫描方式;选择反应监测(MRM)检测方式;喷雾电压3.5 kV;气化温度350℃;鞘气压力(N2) 0.525 L/mL(35 Arb);辅助气压力(N2)3.0 L/mL(10 Arb);离子传输毛细管温度320℃;去簇电压2.0 V;碰撞气体(Ar)199.9 Mpa(1.5 mTorr),定性定量离子对及碰撞能等条件见表1。
结果与讨论
样品提取和净化
丙烯酰胺既易溶于水,又溶于甲醇。考虑到食品样品中淀粉和纤维容易在水中溶胀,体系黏度变大,会导致样品处理变得复杂与费时,甲醇提取能尽可能少地提取多糖甚至是淀粉,又不会引起上述问题。同时对比了两种提取溶液,回收率均能满足要求,不会造成样品提取不充分,所以最终选择用甲醇作为提取溶液。
固相萃取柱的选择:GB 5009.204中采用 HLB和Bond Elut-Accucat 两种固相萃取柱净化, 步骤繁琐,操作复杂,回收率不稳定。本研究选用PRiME HLB固相萃取柱,与传统固相萃取柱相比,PRiMEHLB具有很好的去除非极性物质、蛋白质、脂肪、磷脂的效果,无需活化, 淋洗及洗脱等步骤, 直接上样并接收样品溶液即可, 操作简单,回收率大于80%,不仅可以满足检测需求而且极大的提高检测效率。
基质效应的影响
化学分析中,基质效应是指样品基质中的某些共提取物组分对待测物目标物质的影响,基质常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性。薯片、面包、锅巴、饼干等基质富含油脂蛋白质,为了消除测定液中存在的基质效应,本方法首先在前处理过程中采取除油除蛋白处理,同时采用同位素内标法定量,极大程度消除测定中的基质效应,同时又明显提高了定量的准确性。
质谱条件的优化
采用直接进样方式分别将浓度为1 µg/mL的丙烯酰胺和13C3-丙烯酰胺内标用蠕动泵注入离子源中,在正离子检测方式下进行一级质谱扫描确定它的准分子离子峰,优化毛细管电压、锥孔电压、离子源温度、离子传输管温度;再分别以其准分子离子进行二级质谱扫描,优化碰撞室碰撞电压,选择丰度强、干扰小的离子作为定性或定量离子。优化后的质谱参数见表2。
的选择
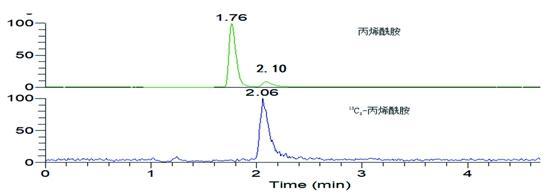
流动相配比及 选择会影响丙烯酰胺的分离及出峰时间,因此本实验考察了Hypersil GOLD aQ(2.0 mm×100 mm,1.9 μm)和Waters Atiantis T3两根 在乙腈/水和甲醇/水2种流动相对丙烯酰胺分离效果。实验表明,丙烯酰胺在Atiantis T3 上的保留行为更好。由于丙烯酰胺是一种强极性的小分子物质,Atiantis T3 是一种基于超纯硅胶基质的反相C18 ,其T3键合技术能增强极性化合物保留,适合强极性物质分离,因此最终选择Atiantis T3 作为实验用柱。同时比较了甲醇/水、甲醇/0.1%甲酸水、乙腈/水、乙腈/0.1%甲酸水等流动相配比对目标化合物离子化程度的影响。结果表明,采用甲醇与0.1%甲酸水体积比为5:95等度洗脱时,丙烯酰胺有较好的出峰,且峰形规则、干扰少,保留时间为2.10 min左右。在实际样品检测时,可以将1.7 min出峰的干扰峰分开。如图1。
图1 含有丙烯酰胺的锅巴样品色谱图
标准曲线和方法检出限
按浓度由小到大的顺序,将基质标准溶液分别注入高效液相色谱/串联质谱仪中,按上述仪器条件进行测定,得到丙烯酰胺及其内标峰面积。以基质标准溶液的浓度为横坐标,以目标化合物峰面积与内标峰面积的比值为纵坐标,绘制标准曲线,并计算线性方程和相关系数。得到的标准曲线线性范围为0~500.0 ng/mL,回归方程为y=1.0365x-0.0152(y为峰面积,Counts;x为浓度,ng/mL);线性相关系数R2=0.9991。同时用空白样品进行加标实验,根据信噪比均大于3的条件设定检出限,得到方法的检出限为5 μg/kg,根据信噪比大于10的条件设定定量限,得到方法的定量限为10 μg/kg。
回收率和精密度
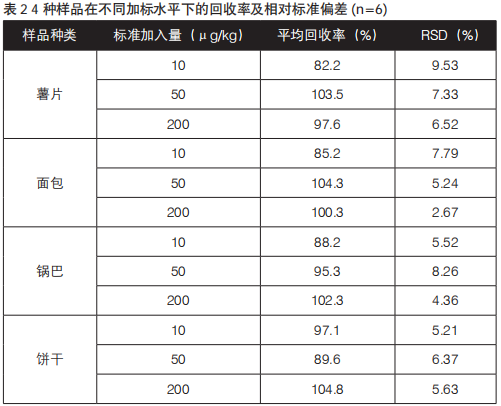
分别选取薯片、面包、锅巴、饼干4种食品,称取每种样品6份,每份2.00 g,共3组,分别加入添加水平为10 μg/kg、50 μg/kg、200 μg/kg的丙烯酰胺标准品,再均添加50 μg/kg内标标准品,按上述样品处理条件进行前处理后上机测定,结果见表2。从表2中可看出,不同浓度平均加标回收率为82.2%~104.8%,平均相对标准偏差为 2.67%~9.53%(n=6),满足试验要求。
实际样品分析
利用本方法对市场销售的薯片、面包、锅巴、饼干4种产品各20份,每份3进行检测,其中薯片类样品中丙烯酰胺的含量为40~1595 μg/kg,油炸型薯片中丙烯酰胺含量普遍高于非油炸型薯片;面包类样品中丙烯酰胺的含量为0~295 μg/kg;锅巴类样品中丙烯酰胺的含量为0~595 μg/kg;饼干类样品中丙烯酰胺的含量为0~695μg/kg。丙烯酰胺的形成与食品的加工方式和加工条件密切相关,有必要合理改变加工方式、严格控制加工条件,减少丙烯酰胺的产生。
结论
本文建立了食品中丙烯酰胺残留的液相色谱-串联质谱测定方法。该方法样品加标回收率方法回收率为82.2%~104.8%,相对标准偏差(RSD)为2.67%~9.53%(n=6)。该方法前处理简单,适合于大量样品的快速筛查,方法的灵敏度和准确度均满足国家标准方法的检测要求,适用于薯片、面包、锅巴、饼干等食品中丙烯酰胺残留的监控检测。
实验与分析
展源
何发
相关文章
-

固相微萃取GC-MS/MS方法应用
2020-05-27
-

HPLC检测器,你了解吗?
2024-03-06
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

做PGS/MS分析时,如何防止焦油状污染物进入毛细柱
2020-05-27
-

做PGS/MS分析时,如何防止焦油状污染物进入毛细柱?
2020-05-27
-

加压流体萃取-HPSE-固相萃取-GC/MS法
2021-01-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

超净工作台原理,使用与维护
2020-05-27

加载更多